Open raceway pond에서 배양된 Nannochloropsis oceanica로부터 오일 추출 및 SO42-/HZSM-5를 이용한 바이오디젤 전환
 ; Joo Chang Park2)
; Joo Chang Park2) ; Min-Cheol Kim3)
; Min-Cheol Kim3) ; Deog-Keun Kim1)
; Deog-Keun Kim1) ; Hyung-Taek Kim4)
; Hyung-Taek Kim4) ; Hoseob Chang5)
; Hoseob Chang5) ; Jun Cheng6)
; Jun Cheng6) ; Weijuan Yang6)
; Weijuan Yang6)
Copyright © 2023 by the New & Renewable Energy
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In this study, microalgal oil was extracted from Nannochloropsis oceanica cultured in an open raceway pond and converted into biodiesel using a solid acid catalyst. Microalgal oil was extracted from two types of microalgae with and without nitrogen starvation using the KOH-solvent extraction method and the fatty acid content and oil extraction yield from each microalgae were compared. The fatty acid content of N. oceanica was 184.8 mg/g cell under basic conditions, and the oil content increased to 340.1 mg/g under nitrogen starvation conditions. Oil extraction yields were 90.8 and 95.4% in the first extraction, and increased to 97.5 and 98.8% after the second extraction. Microalgal oil extracted by KOH-solvent extraction was yellow in color and had reduced viscosity due to chlorophyll removal. In biodiesel conversion using the catalyst SO42-/HZSM-5, solvent-extracted oil showed a FAME content of 4.8%, while KOH-solvent-extracted oil showed a FAME content of 90.4%. Solid acid catalyst application has been made easier by removal of chlorophyll from microalgal oil. The FAME content increased to 96.6% upon distillation, and the oxidation stability increased to 11.07 h with addition of rapeseed biodiesel and 1,000 ppm butylated hydroxyanisole.
Keywords:
Microalgal oil, Nannochloropsis oceanica, Chlorophyll removal, Biodiesel, Oxidation stability improvement키워드:
미세조류 오일, 나노클로롭시스 오세아니카, 엽록소 제거, 바이오디젤, 산화안정성 개선1. 서 론
우리나라는 석유 부존자원이 없으며 대부분 수입에 의존하고 있다. 따라서 국제유가, 기후변화, 정치환경 변화 등에 의한 수급 상황에 따라 경제가 크게 영향을 받고 있으며, 국내 기술 및 자본을 이용한 대체에너지 기술 개발 및 자원 확보가 절실한 상황이다. 현재 기후변화협약에 대비하기 위하여 에너지효율화 기술 및 태양, 풍력 등 재생에너지 기술에 대한 투자가 확대되고 있으나, 수송용 액체 연료인 석유 대체에는 어느 정도 한계가 있다. 바이오디젤은 기존 경유에 비해 미세분진, 황화합물 등의 오염물질 배출을 줄일 수 있는 친환경 자동차 연료로 적합하다.[1~5] 이들 연료의 연소에서 나오는 이산화탄소는 다시 식물 등에 흡수, 고정되므로 이산화탄소의 순 배출이 거의 없다. 그러나 현재 바이오디젤은 주로 대두, 유채 등의 식용작물의 식물성 기름을 이용해 생산되고 있으며, 이는 곡물가격 상승을 유발하여 식량난을 가중시킨다는 비판을 받고 있다. 우리나라는 바이오디젤의 원료(팜유) 대부분을 수입하고 있으므로 수급 및 가격이 석유자원과 유사하게 대외적인 상황 변화에 크게 의존할 가능성이 높다. 이와 같은 문제점을 해결하기 위해 기존 식용작물 대신 미세조류를 원료로 활용하여 바이오디젤을 생산하는 기술이 차세대 바이오디젤 기술로 많은 관심을 받고 있다.[6~8] 바이오디젤은 식물성 기름 또는 동물성 유지로부터 생산된 지방산의 메틸/에틸 에스테르 화합물로 정의된다. 미세조류는 기존 바이오디젤 원료인 육상작물(대두, 유채, 팜 등)과 토지나 공간 측면에서 경쟁하지 않고, 식용작물 사용의 윤리문제에서 벗어나 있으며, 단위 면적당 오일 생산량이 육상작물에 비해 10-100배 높다. 국내 바이오디젤 생산 원료는 일부 국내 폐식용유를 이용하며, 나머지는 해외 수입에 의존하고 있는 실정이라 해외 원료의 가격 변동에 크게 영향을 받는다. 2023년 국내 RFS에 따른 바이오디젤 의무보급량은 70만 kL/년이며 2030년까지 점차 증가할 계획이다.
미세조류 바이오디젤 생산 공정은 크게 1) 고효율 미세조류 균주 개발, 2) 대량 배양, 3) 미세조류 수확, 4) 오일 추출, 5) 바이오디젤 전환, 6) 미세조류 부산물 활용 등으로 구성된다. 미세조류 바이오디젤 생산 공정 중 미세조류 대량 배양 단계는 전체 공정의 경제성을 좌우하는 주요 부분이다.[9~11] 미세조류 바이오디젤 가격은 미세조류 배양 규모 및 바이오디젤 전환 방법에 따라 크게 좌우되며, 아직은 경유 대비 2-5배의 가격으로 추정된다. 미세조류 오일 추출 공정은 미세조류의 특성(미세조류 크기, 세포벽 두께, 오일 함량, 유리지방산 함량, 단백질/탄수화물 함량, 오일 불포화도 등)에 맞게 적용해야 하며 물리적, 화학적, 열화학적 방법 등 다양한 오일 추출법이 적용된다.[12,13] 일부 오일 추출 공정은 수분이 존재하는 습식 조건에서 적용 가능하며, 일부 공정은 수분에 의한 저해로 공정 효율이 급격히 낮아지므로 현 시점에서는 건조 공정을 필요로 한다. 미세조류 수확 후 미세조류 내 수분 함량은 대략 60-80% 정도이며, 추가 탈수나 건조 공정에서 에너지 비용을 소모해야 한다. 미세조류 오일은 바이오디젤 전환 가능한 성분인 트리글리세리드, 유리지방산 외 색소, 인지질, 당지질 등을 함유하고 있다.[14] 바이오디젤 전환 시 트리글리세리드만 존재하면 염기 촉매 공정 적용이 가능하지만, 트리글리세리드와 유리지방산 두 가지가 혼합되어 존재할 경우 유리지방산이 염기 촉매와 반응해 비누를 형성하여 오일의 손실을 야기하고 바이오디젤 층의 분리를 저해한다.[15] 미세조류 오일은 색소, 인지질, 당지질 등을 같이 포함하고 있어 촉매의 에스테르화 성능을 저해하므로 미세조류 오일의 특성에 맞은 에스테르화 반응 촉매가 필요하다.
본 연구에서는 질소결핍 유무에 따라 배양된 Nannochloropsis oceanica의 지방산 성분을 비교하고, KOH-용매추출법을 이용하여 오일을 추출하였다. 또한 추출된 미세조류 오일로부터 고체 산 촉매를 이용한 에스테르화 반응을 통해 바이오디젤 전환 가능성을 확인하고, 산화안정성 개선 첨가제를 이용하여 바이오디젤의 산화안정성 개선을 검토하였다.
2. 실 험
2.1 실험 재료
중국의 Yantai Hearol Biotechnology Co., Ltd.에서 배양하여 수확한 N. oceanica를 공급받아 오일 추출 및 바이오디젤 전환을 위한 미세조류로 사용하였다(Fig. 1 참조). 미세조류는 1,200 m2 open raceway pond에서 석탄화력발전소의 15% CO2 flue gas를 이용하여 배양되었으며, 질소결핍 유무에 따라 배양된 두 가지 미세조류를 공급받았다. KOH-용매추출법에 이용된 용매는 헥산(Junsei, 96%), 메탄올(Junsei, 99.6%)이며, 첨가제로 KOH(삼전화학, 95%)가 사용되었다. 유채 바이오디젤은 유채유(해표)를 이용하여 제조되었다.
미세조류 바이오디젤의 산화안정성 개선을 위하여 5종의 첨가제를 비교하였다. Sigma-Aldrich사의 tert-butylhydroquinone(97%), propyl gallate(98%), butylated hydroxyanisole(99%), butylated hydroxytoluene(99%), pyrogallol(98%)을 사용하였다.
2.2 촉매 제조
고체 산 촉매 제조를 위하여 ZEOLYST사에서 구입한 제올라이트 지지체(no. CBV 8014, Si/Al ratio 80)를 550°C에서 5시간 동안 소성하여 준비하였다. 촉매 1 g당 증류수에 용해된 황산(H2SO4) 용액 40 mL를 사용하여 교반 후 증발기를 이용하여 증류수를 제거하였다. 105°C 오븐에서 충분히 건조시킨 후 500°C에서 5시간 소성하여 SO42-/HZSM-5 촉매를 제조하였다. 황산 담지량은 제올라이트 대비 6%로 하였다.
2.3 실험 방법
미세조류에 대하여 헥산:메탄올=7:3(v/v)의 용매 조건에서 건조 미세조류 대비 10%의 KOH를 용매와 혼합하여 오일을 추출하여 오일 추출율을 측정하였다. 미세조류 양은 용매 대비 5%(w/w)였으며, 1,000 rpm에서 6시간 동안 충분히 교반한 뒤 오일을 포함하는 용매층을 회수하여 감압증발(Genevac, EZ2 PLUS)하여 용매를 휘발시키고 남아있는 오일을 회수하였다.
오일 추출율은 식 (1)과 같이 계산되었다. 미세조류가 가지고 있는 오일의 총 질량은 수정된 direct trans-esterification법을 이용하여 측정한 값을 사용하였다.
| (1) |
추출된 미세조류 오일의 바이오디젤 전환 가능성을 확인하기 위하여 충분한 양의 메탄올과 균일계 및 고체 산 촉매를 이용하여 에스테르화 반응을 수행하였다. 미세조류 오일 대비 메탄올 양은 1:1(w/w)로 하였으며 촉매는 균일계의 경우 2%, 고체 산 촉매의 경우 10%를 사용하였으며, 120°C에서 2시간 반응시켜 바이오디젤로 전환하였다. 증류수로 세정 후 전환된 바이오디젤의 지방산 메틸 에스테르(fatty acid methyl ester, FAME) 함량을 가스 크로마토그래프를 이용하여 분석하였다. 사용된 균일계 촉매는 염기 촉매인 KOH와 산 촉매인 황산이고, 사용된 고체 산 촉매는 HZSM-5와 제조한 SO42-/HZSM-5였다. 증류된 바이오디젤은 둥근 플라스크에 전환된 바이오디젤을 넣고 200°C로 가열하여 감압증류(30 mbar)를 통해 바이오디젤을 휘발시킨 후, 냉각된 바이오디젤을 회수하여 얻어졌다.
2.4 분석 방법
미세조류의 총 지방산 함량을 측정하기 위해 수정된 direct trans-esterification법을 사용하였다.[16] 건조 미세조류 10 mg을 test tube에 넣고 클로로포름-메탄올(2:1, v/v) 2 mL을 넣은 뒤 vortex mixer로 10분간 섞어주고 내부 표준물질인 heptadecanoic acid-chloroform solution(Sigma-Aldrich, 500 μg/L) 1 mL을 넣고 메탄올 1 mL와 황산 0.3 mL을 넣어준다. Vortex mixer로 10분간 섞어준 뒤 100°C 항온조에서 10분간 반응시킨 후 상온에서 충분히 식혀준다. 식힌 test tube에 증류수 1 mL을 첨가한 뒤 vortex mixer로 5분간 섞은 후 원심분리기(4,000 rpm, 10분)에서 원심분리하고 층분리된 용액 중 아래층을 주사기로 뽑고 필터로 여과 후 vial에 1 mL을 넣고 가스 크로마토그래피(Agilent 7890)로 분석한다. 외부 표준물질로 Mix RM3, Mix RM5, GLC50, GLC70(Supelco)을 사용하여 지방산의 정량 분석을 수행하였다.
바이오디젤 전환 반응 후 지방산 메틸 에스테르(FAME)는 표준분석조건 EN 14103에 따라 분석하였다.[17] 250 mg 시료가 내부 표준물질인 methyl heptadecanoate-heptane solution(Fluka, 10 mg/g) 5 mL과 교반된 후 가스 크로마토그래피(Agilent 6890)로 분석하였다. FAME의 검출 및 분리를 위해 사용한 컬럼은 HP-INNOWAX capillary column(30 m×0.32 mm×0.5 μm)이다. Carrier gas로는 헬륨을 사용하였고, split mode의 split ratio는 45:1로 하였으며 헬륨가스 유속은 2.2 mL/min이었다. 오븐의 온도는 250°C까지 증가하며, 인젝터의 온도는 250°C, 검출기의 온도는 275°C로 하였다.
산화안정성 측정은 743 Rancimat(Metrohm)을 이용하여 수행되었다. 3.0 g의 시료를 110°C에서 가열하면서 10 L/h의 공기를 공급하여 가속 산화시켜 전기전도도가 급격히 증가하는 시점을 찾아 그 시점으로부터 산화안정성을 측정하였다.
3. 결과 및 고찰
3.1 N. oceanica의 지방산 함량 분포
N. oceanica의 지방산 함량 분포를 Table 1에 나타내었다. N. oceanica의 총 지방산 함량은 기본배지와 질소결핍 조건에서 각각 184.8, 340.1 mg/g cell로서 건조 중량 대비 cell 당 약 18.5, 34.0%의 지방산을 함유하고 있는 것으로 확인되었으며 이는 N. oceanica의 바이오디젤 전환 가능한 성분을 의미한다. 지방산 중에서 주요 구성성분은 탄소수 16인 포화지방산 palmitic acid(C16:0)와 불포화지방산 palmitoleic acid(C16:1)로, 오일 대비 각각 28.7, 19.1%를 차지하고 있었다. Etc.에는 홀수 개의 탄소수 지방산이나 불포화 결합을 다량 포함한 지방산들이 포함되었다. 질소결핍 조건에서 배양된 시료의 오일 함량은 기본배지에서 배양된 미세조류의 오일 함량보다 높게 나타났다. 기본배지에서는 오일 대비 20.2%의 오메가 지방산(EPA)을 함유하고 있으며, 질소결핍 조건에서는 오일 대비 8.4%로 낮은 오메가 지방산(EPA) 함량을 나타내었고, EPA의 총량도 낮게 나타났다. 질소결핍 조건에서는 총 오일 함량은 증가하고, EPA 함량은 감소하는 경향을 나타내었다.[18,19]
3.2 미세조류 오일 추출율
기본배지에서 배양한 미세조류에 대하여 헥산:메탄올=7:3(v/v) 용매를 이용하여 오일을 추출하면 진녹색의 점도가 있는 미세조류 오일을 추출할 수 있으며, 오일 추출율은 87.2%였다(Fig. 2(b) 참조). 용매로 헥산만 이용시 오일 추출율이 49.6%인데 반해 헥산-메탄올 용매에서 추출율이 증가하였다. 비극성 유기용매인 헥산에 극성 유기용매인 메탄올을 혼합하여 오일 추출율을 향상시킬 수 있었다.
용매를 이용하여 오일을 추출하면 추출된 미세조류 오일은 트리글리세리드, 유리지방산, 엽록소, 인지질, 당지질 등을 포함할 수 있으며, 이 중에서 트리글리세리드 및 유리지방산 부분이 바이오디젤로 전환 가능한 부분이다(Fig. 3 참조). 엽록소는 녹색을 띠는 색소로 바이오디젤 전환시 촉매 반응을 저해하여 전환율 및 수율을 감소시킨다.
미세조류에 대하여 KOH-용매추출법을 이용하여 오일을 추출하였다. 헥산:메탄올=7:3(v/v)의 용매 조건에서 건조 미세조류 대비 10%의 KOH를 용매와 혼합하여 오일을 추출하였다. KOH 첨가 없이 추출한 오일이 진녹색을 띠는 반면, KOH를 첨가하였을 경우 엽록소가 추가적으로 제거되어 오일이 노란색을 띠고 점도도 감소하였다(Fig. 2(c) 참조). 엽록소는 NaOH 존재하에 수용성 물질인 chlorophyllin과 phytol을 다음 반응에 의하여 생산하게 되고, 수세 단계에서 이들 물질이 미세조류 오일로부터 제거되어 엽록소가 제거된 오일을 얻을 수 있다.[20,21] 본 연구에서는 KOH가 동일한 역할을 수행하였다.
기본배지 및 질소결핍 조건에서 배양한 미세조류에 대하여 1차 오일 추출율을 비교하면, 기본배지 시료보다 질소결핍 조건의 시료에서 높게 나타났다(Table 2 참조). 오일 함량이 높은 경우에 오일과 용매의 접촉 기회가 많아져서, 오일 추출이 용이해지는 특성을 보였다. 2차 오일 추출까지 수행한 후에 총 오일 추출율은 97% 이상으로 매우 높게 나타났다.
3.3 추출 오일의 바이오디젤 전환
KOH, H2SO4, HZSM-5, SO42-/HZSM-5 네 가지 촉매를 이용하여 용매추출법과 KOH-용매추출법으로 추출한 두 가지 미세조류 오일의 바이오디젤 전환을 FAME 함량으로 나타내었다(Table 3 참조). 용매추출법으로 추출한 오일에 대하여 균일계 KOH 촉매는 가장 높은 FAME 함량을 나타내었으며, 황산 촉매도 비교적 높은 FAME 함량을 나타내었다. 반면 고체 산 촉매 HZSM-5는 미세조류 오일 내 엽록소의 저해 작용으로 2.3%의 낮은 함량을 나타내었다. KOH-용매추출법으로 물성 개선된 미세조류 오일에 대하여 바이오디젤 전환을 위한 KOH 및 황산 촉매에 대하여 FAME 함량은 각각 기존의 용매추출법으로 추출한 미세조류 오일에 비하여 7 및 5% 향상되었다. SO42-/HZSM-5 촉매에 대하여 FAME 함량은 90.4%까지 크게 증가하여 분리가 용이하고 회수 후 재사용이 가능하고, 중화 및 수세 공정을 통한 폐수 발생이나 추가 에너지 소모가 없는 고체 산 촉매를 이용한 미세조류 바이오디젤의 생산 가능성을 확인하였다.
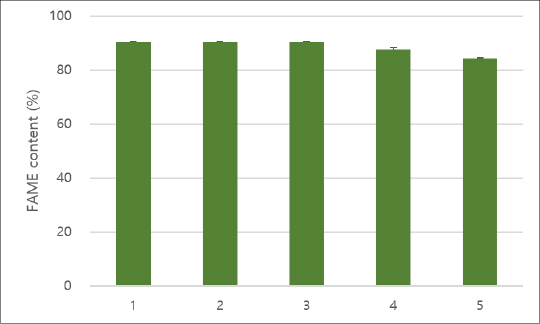
SO42-/HZSM-5 촉매에 5회 재사용 실험을 수행한 결과, FAME 함량은 3회까지는 90% 이상으로 유지되었으며, 4회 이후에는 87.6, 84.2%로 FAME 함량이 일부 감소하여, 추후 촉매 내구성 확보 실험이 더 필요한 것으로 나타났다. Shen et al.(2023)의 연구에서 N. oculata로부터 추출된 미세조류 오일을 microalgae carbon based magnetic solid acid catalyst(MCMSA)를 이용한 microwave 적용 바이오디젤 전환 공정으로 최대 98.5%의 FAME 전환율을 얻었지만, 5회 재사용 실험에서는 전환율이 70%까지 감소하는 양상을 나타내었다.[8] Syazwani et al.(2015)의 연구에서는 N. oculata로부터 추출된 미세조류 오일을 조개껍질 유래 촉매를 이용하여 바이오디젤로 전환하였다. 최대 FAME 수율은 84.1%였으며, 오일:메탄올 몰비를 1:150까지 증가시켜 반응을 진행하였다.[22]
3.4 바이오디젤 산화안정성 개선
FAME 함량이 90.4%인 미세조류에 대하여 증류 공정을 통하여 바이오디젤 순도를 개선하였다. 200°C에서 감압증류를 통하여 1, 2, 3차 증류를 수행한 결과 FAME 함량은 각각 96.6, 97.0, 97.1%까지 증가하였으며, 1차 증류를 통하여 바이오디젤 물성 기준치인 96.5% 이상을 만족하였다(Fig. 5 참조). 1, 2, 3차 증류에 따른 바이오디젤 수율은 각각 88.7, 96.1, 98.1%였다.
산화안정성은 바이오디젤의 지방산 함량 분포와 밀접한 관련이 있다. 포화지방산 및 이중 결합 1개까지의 불포화지방산 함량이 많을 때는 높은 산화안정성을 나타내고, 이중 결합 2개 이상의 불포화지방산 햠량이 많을 때는 낮은 산화안정성을 보인다.[23] 바이오디젤의 산화가 지방산의 이중 결합 부분에서 발생하기 때문이며, monoallyric methylene보다 bisallyric methylene 구조에서 산화 속도가 더 빠르기 때문이다.[24]
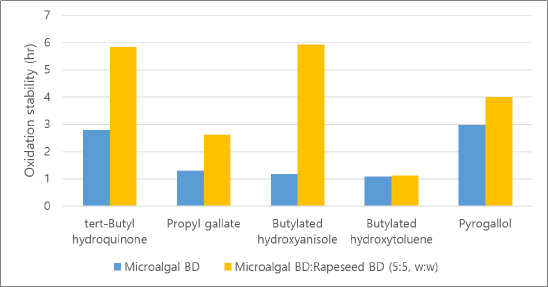
200°C에서 증류한 미세조류 바이오디젤의 산화안정성은 0.85시간으로, 바이오디젤 물성 기준치인 6시간 이상을 만족시키기 위하여 물성 개선이 필요하였다. N. oceanica는 이중 결합이 5개인 오메가 지방산(EPA)의 함량이 높아 낮은 산화안정성 특성을 보인다. 또한 미세조류 바이오디젤의 증류 공정에서 미세조류가 가지고 있는 고유의 산화안정성 개선 성분도 소멸되어 더 낮은 산화안정성을 나타내었다. 적합한 산화안정성 개선 첨가제를 선정하기 위하여 tert-butylhydroquinon, propyl gallate, butylated hydroxyanisole, butylated hydroxytoluene, pyrogallol 5종의 첨가제를 500 ppm 농도로 혼합하여 산화안정성을 측정하였다(Fig. 6 참조). 미세조류 바이오디젤은 pyrogallol에서 산화안정성 개선 효과가 가장 높았으며 tert-butylhydroquinone에서도 높게 나타났다. Butylated hydroxytoluene에서 산화안정성 개선 효과가 가장 미비하였다.
Pyrogallol의 농도에 따른 산화안정성 개선 효과를 검토하였다. 첨가제의 농도가 증가할수록 산화안정성이 증가하는 것을 확인하였다(Table 4 참조). Pyrogallol를 1,500 ppm 이상 혼합하였을 때는 산화안정성이 더 이상 증가하지 않았다.
산화안정성 개선을 위하여 다른 바이오디젤과 혼합할 수 있다. 미세조류 바이오디젤과 유채 바이오디젤을 5:5(w/w)로 혼합하고, 각 첨가제를 500 ppm 혼합하여 산화안정성을 측정하였다. 유채 바이오디젤은 이중 결합 1개의 불포화지방산이 많은 특성을 가지므로 산화안정성이 높은 편에 속한다. 유채 바이오디젤을 혼합한 미세조류 바이오디젤에서는 butylated hydroxyanisole의 산화안정성 개선효과가 가장 뛰어났으며, tert-butylhydroquinone에서도 높은 산화안정성을 나타내었다(Fig. 6 참조). 또한 butylated hydroxyanisole에 대하여 유채 바이오디젤의 혼합 비율에 따른 영향을 검토한 결과, 미세조류 바이오디젤에 유채 바이오디젤의 혼합 비율이 높을수록 산화안정성이 점차 증가하는 것을 알 수 있었다(Table 5 참조). 혼합 비율 4:6(w/w) 및 2:8(w/w)에서 산화안정성은 6시간 이상으로 크게 증가하였다.
Butylated hydroxyanisole의 농도에 따른 유채 바이오디젤 혼합 미세조류 바이오디젤의 산화안정성 개선 효과를 살펴보았다. 1,000 ppm에서 11.07시간, 1,500 ppm에서 13.36시간까지 산화안정성이 개선되었다(Table 6 참조). Butylated hydroxyanisole 첨가제를 1,500 ppm 이상 혼합하였을 때는 산화안정성이 더 이상 증가하지 않았다. 유채 바이오디젤과의 혼합 및 첨가제 농도의 증가를 통해 산화안정성을 바이오디젤 물성 기준치인 6시간 이상으로 증가시킬 수 있었다. Bucy et al.(2012)은 오메가 지방산인 EPA/DHA 함량이 증가하면 산화안정성이 감소하는 결과를 확인하였다. Nannochloropsis sp. 유래 바이오디젤의 산화안정성은 1.5시간이었으며, 산화안정제 tert-butylhydroquinone 1,000 ppm을 첨가한 경우 산화안정성은 7.5시간으로 향상되었다.[25]
4. 결 론
Open raceway pond에서 배양된 N. oceanica로부터 효율적으로 미세조류 오일을 추출하고, 고체 산 촉매를 사용하여 바이오디젤로 전환하고, 바이오디젤의 산화안정성을 개선하였다. 질소결핍 유무에 따른 두 가지 미세조류에 대하여 KOH-용매추출법을 이용하여 미세조류 오일을 추출하였는데, KOH-용매추출법으로 추출된 미세조류 오일은 엽록소가 제거되어 노란색을 띠고 점도가 감소하였다. KOH-용매추출 오일에 대한 고체 산 촉매의 적용에서 FAME 함량은 90.4%까지 증가하여 엽록소 제거로 인한 촉매 저해 작용 감소를 확인하였다. 증류 공정을 통해 FAME 함량을 바이오디젤 물성 기준치 96.5% 이상으로 증가시켰고, 유채 바이오디젤 및 첨가제 butylated hydroxyanisole 혼합으로 산화안정성도 기준치 6시간 이상으로 향상시켰다.
Acknowledgments
이 논문은 2018년도 정부(과학기술정보통신부)의 재원으로 한국연구재단-과학기술국제화사업의 지원을 받아 수행되었습니다(No. NRF-2018K1A3A1A61024274).
References
-
Monika, Banga, S., and Pathak, V.V., 2023, “Biodiesel production from waste cooking oil: A comprehensive review on the application of heterogenous catalysts”, Energy Nexus, 10, 100209.
[https://doi.org/10.1016/j.nexus.2023.100209]

- Jung, C.S., Lee, Y.J., and Dong, J.I., 2007, “Life time estimation of biodiesel and biodiesel blend fuel from the oxidation stability analysis”, New. Renew. Energy, 3(2), 17-23.
-
Rocha-Meneses, L., Hari, A., Inayat, A., Yousef, L.A., Alarab, S., Abdallah, M., Shanableh, A., Ghenai, C., Shanmugam, S., and Kikas, T., 2023, “Recent advances on biodiesel production from waste cooking oil (WCO): A review of reactors, catalysts, and optimization techniques impacting the production”, Fuel, 348, 128514.
[https://doi.org/10.1016/j.fuel.2023.128514]

- Hur, K.B., Park, J.K., Rhim, S.G., and Kim, S.C., 2009, “Feasibility evaluation & strategy of replacement of power generation fuel by using bio-diesel”, New. Renew. Energy, 5(1), 32-39.
-
Lee, T.S., Lee, Y.H., Kim, G.S., Kim, W., Kim, K.S., Jung, Y.S., and Park, K.G., 2012, “Yield and characterization of various biodiesel from vegetable oils and animal fats”, New. Renew. Energy, 8(4), 30-37.
[https://doi.org/10.7849/ksnre.2012.8.4.030]

-
Mittal, V., and Ghosh, U.K., 2023, “Optimization of biodiesel production from Spirulina microalgae via nanocatalytic transesterification process”, Bioresour. Technol., 23, 101504.
[https://doi.org/10.1016/j.biteb.2023.101504]

-
Thanh, N.T., Mostapha, M., Lam, M.K., Ishak, S., Dasan, Y.K., Lim, J.W., Tan, I.S., Lau, S.Y., Chin, B.L.F., and Hadibarata, T., 2022, “Fundamental understanding of in-situ transesterification of microalgae biomass to biodiesel: A critical review”, Energy Convers. Manag., 270, 116212.
[https://doi.org/10.1016/j.enconman.2022.116212]

-
Shen, Y., Zhang, Q., Sun, X., Zhang, Y., Cai, Q., Deng, W., Rao, S., Wu, X., and Ye, Q., 2023, “Conversion of wet microalgae to biodiesel with microalgae carbon based magnetic solid acid catalyst”, Energy Convers. Manag., 286, 117022.
[https://doi.org/10.1016/j.enconman.2023.117022]

-
Faried, M., Samer, M., Abdelsalam, E., Yousef, R.S., Attia, Y.A., and Ali, A.S., 2017, “Biodiesel production from microalgae: Processes, technologies and recent advancements”, Renew. Sust. Energ. Rev., 79, 893-913.
[https://doi.org/10.1016/j.rser.2017.05.199]

-
Collotta, M., Busi, L., Champagne, P., Romagnoli, F., Tomasoni, G., Mabee, W., and Alberti, M., 2017, “Comparative LCA of three alternative technologies for lipid extraction in biodiesel from microalgae production”, Energy Procedia, 113, 244-250.
[https://doi.org/10.1016/j.egypro.2017.04.061]

-
Nazloo, E.K., Moheimani, N.R., and Ennaceri, H., 2022, “Biodiesel production from wet microalgae: Progress and challenges”, Algal Research, 68, 102902.
[https://doi.org/10.1016/j.algal.2022.102902]

-
Park, J.Y., Park, M.S., Lee, Y.C., and Yang, J.W., 2015, “Advances in direct transesterification of algal oils from wet biomass”, Bioresource Technology, 184, 267-275.
[https://doi.org/10.1016/j.biortech.2014.10.089]

-
Park, J.Y., Kim, M.C., Nam, B., Chang, H., and Kim, D.K., 2021, “Behavior of surfactants in oil extraction by surfactant-assisted acidic hydrothermal process from Chlorella vulgaris”, Appl. Biochem. Biotechnol., 193, 319-334.
[https://doi.org/10.1007/s12010-020-03426-3]

-
Park, J.Y., Kim, M.C., Cheng, J., Yang, W., and Kim, D.K., 2020, “Extraction of microalgal oil from Nannochloropsis oceanica by potassium hydroxide-assisted solvent extraction for heterogeneous transesterification”, Renewable Energy, 162, 2056-2065.
[https://doi.org/10.1016/j.renene.2020.10.049]

-
Kim, J.Y., Jung, J.M., Jung, S., Park, Y.K., Tsang, Y.F., Lin, K.Y.A., Choi, Y.E., and Kwon, E.E., 2022, “Biodiesel from microalgae: Recent progress and key challenges”, Progress in Energy and Combustion Science, 93, 101020.
[https://doi.org/10.1016/j.pecs.2022.101020]

-
Lepage, G., and Roy, C.C., 1984, “Improved recovery of fatty acid through direct transesterification without prior extraction or purification”, Journal of Lipid Research, 25(12), 1391-1396.
[https://doi.org/10.1016/S0022-2275(20)34457-6]

- CEN, EN 14103, 2001, “Fat and oil derivatives - Fatty acid methyl esters (FAME) - Determination of ester and linoleic acid methyl ester contents”.
-
Roncaglia, B., Papini, A., Zittelli, G.C., Rodolfi, L., and Tredici, M.R., 2021, “Cell wall and organelle modifications during nitrogen starvation in Nanochloropsis oceanica F&M-M24”, J. Appl. Phycol., 33, 2069-2080.
[https://doi.org/10.1007/s10811-021-02416-0]

-
Janssen, J.H., Wijffels, R.H., and Barbosa, M.J., 2019, “Lipid production in Nannochloropsis gaditana during nitrogen starvation”, Biology, 8(1), 5.
[https://doi.org/10.3390/biology8010005]

-
Ferruzzi, M.G., and Blakeslee, J., 2007, “Digestion, absorption, and cancer preventative activity of dietary chlorophyll derivatives”, Nutrition Research, 27(1), 1-12.
[https://doi.org/10.1016/j.nutres.2006.12.003]

-
Li, T., Xu, J., Wu, H., Wang, G., Dai, S., Fan, J., He, H., and Xiang, W., 2016, “A saponification method for chlorophyll removal from microalgae biomass as oil feedstock”, Mar. Drugs, 14(9), 162.
[https://doi.org/10.3390/md14090162]

-
Syazwani, O.N., Rashid, U., and Yap, Y.H.T., 2015, “Low-cost solid catalyst derived from waste Cyrtopleura costata (Angel Wing Shell) for biodiesel production using microalgae oil”, Energy Convers. Manag., 101, 749-756.
[https://doi.org/10.1016/j.enconman.2015.05.075]

-
Park, J.Y., Kim, D.K., Lee, J.P., Park, S.C., Kim, Y.J., and Lee, J.S., 2008, “Blending effects of biodiesels on oxidation stability and low temperature flow properties”, Bioresour. Technol., 99(5), 1196-1203.
[https://doi.org/10.1016/j.biortech.2007.02.017]

-
Bucy, H.B., Baumgardner, M.E., and Marchese, A.J., 2012, “Chemical and physical properties of algal methyl ester biodiesel containing varying levels of methyl eicosapentaenoate and methyl docosahexaenoate”, Algal Research, 1(1), 57-69.
[https://doi.org/10.1016/j.algal.2012.02.001]