
Online publication date 14 Dec 2020
펜톤산화에 의한 바이오매스 분해향상과 펜톤산화 용액 재사용 평가
Copyright © 2020 by the New & Renewable Energy
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In this study, the reusability of the Fenton oxidation solution was evaluated to reduce the cost of the pretreatment process. Biomass was sequential subjected to Fenton oxidation-hydrothermal treatment and enzymatic hydrolysis to produce monosaccharides. The liquid solution recovered after Fenton oxidation contained OH radicals with a concentration of 0.11 mol/L. This liquid solution was reused for a new Fenton oxidation reaction. After Fenton oxidation, hydrothermal treatment was performed under the same conditions as before, and 9.34-13.63 g/L of xylose was detected. This concentration was slightly lower than that of a fresh Fenton oxidation solution (16.51 g/L) but was higher than that obtained by hydrothermal treatment without Fenton oxidation (2.72 g/L). The degradation rate during hydrothermal pretreatment involving Fenton oxidation was 36.02%, which decreased (29.24-31.05%) slightly when the liquid solution recovered after Fenton oxidation was reused. However, the degradation rate increased compared to that measured from hydrothermal treatment without Fenton oxidation (15.21%). Moreover, the yield after enzyme hydrolysis decreased in the following order: fresh Fenton oxidation-hydrothermal treatment (89.64%) > Fenton oxidation with reused solution-hydrothermal treatment (74.84%) > hydrothermal treatment without Fenton oxidation (32.05%).
Keywords:
Fenton oxidation, Hydrothermal treatment, Biomass, Reusability키워드:
펜톤산화, 열수처리, 바이오매스, 재사용도1. 서 론
전 세계적으로 재생 가능한 친환경자원의 수요가 급증함에 따라 목질계 바이오매스를 이용한 바이오연료 및 바이오리파이너리 산업이 발전하고 있다. 목질계 바이오매스는 주요 구성성분인 셀룰로오스, 헤미셀룰로오스, 리그닌이 유기적으로 결합된 난분해성 구조를 이루며 이러한 특징은 다당류의 효율적인 이용을 제한한다[1,2]. 전처리는 바이오매스 구성성분을 가수분해하여 효소의 셀룰로오스 접근성을 향상시키는 공정으로 목질계 바이오매스 활용을 위해 필요한 공정이다[3]. 일반적으로 전처리는 물리적, 화학적, 생물학적 전처리 또는 이들을 결합한 방법이 사용되고 있으며, 방법에 따라 오랜 반응 시간과 고온, 고압 조건을 필요로 한다. 특히 산 촉매를 사용할 경우, 장치의 부식, 발효 저해물질을 생산하는 문제점을 가진다[4,5]. 뿐만 아니라 많은 에너지와 유지관리비용을 소모하기 때문에 목질계 바이오매스의 효율적인 전처리 기술 개발이 필요하다[6].
목재의 생분해 거동을 기반으로 한 펜톤산화는 비교적 낮은 반응조건에서 수행되는 친환경적인 공정으로 유기물 분해에 효과적인 것으로 알려져 있다[7]. 일반적인 펜톤산화는 산성 조건하에 H2O2와 Fe2+가 함유된 펜톤시약을 이용하고, 주로 폐수의 독성 및 유기화학물질을 분해하는데 사용되어 왔다[8]. 최근에는 효소가수분해를 향상시키기 위해 목질계 바이오매스의 전처리에 펜톤산화가 적용되고 있다[5,9,10]. 펜톤산화에 의한 목질계 바이오매스 초기 분해는 Fe2+과 H2O2가 반응하여 OH 라디칼이 생성되어 시작된다[11]. 강한 산화 능력을 가진 OH 라디칼은 목질계 바이오매스의 셀룰로오스, 헤미셀룰로오스, 리그닌을 비선택적으로 분해하여 효소의 접근성을 향상시킬 수 있다[12].
최근 여러 연구자들은 펜톤산화와 다양한 화학적 전처리를 결합한 복합적인 전처리 공정을 제안하였다[5,9,13]. 적절한 전처리 방법의 조합은 기존 단일 공정 기술의 단점을 극복하고 시너지 효과를 준다. 그러나 이러한 방법은 공정 처리 시간을 증가시키고 다량의 물이 사용되어 산업적 적용에 제한이 있다. 이와 같은 문제를 해결하기 위해 일부 연구자들은 전처리 후 생산되는 액상가수분해산물을 전처리에 재사용하고 있다[14,15]. 액상가수분해산물의 재사용은 액상 내 화학 물질의 재활용 가능하게 하고 물과 에너지 소비를 절감하는 경제적 이점을 제공한다[14,16,17]. 액상의 재사용은 목질계 바이오매스의 펜톤산화 과정에도 적용 가능하다. 물의 소비를 최소화하기 위한 방안으로 펜톤산화 공정에서 발생한 액상을 펜톤산화에 재사용하는 것은 전처리 공정비용을 감소시킬 수 있다. 또한 펜톤산화 액상은 OH 라디칼과 Fe 이온 등을 포함하고 있어 펜톤시약 공급원으로 작용하여 전처리 공정의 비용 절감을 유도할 수 있다[8,18]
본 연구에서는 바이오매스 펜톤산화 후 회수한 액상의 재사용 가능성을 평가하고자 펜톤산화-열수처리 공정에 회수된 펜톤산화 액상을 적용하였다. 재사용 가능성은 펜톤산화 후 생성된 가수분해산물과 효소가수분해 수율로 비교 분석하였다.
2. 재료 및 방법
2.1 바이오매스
본 연구에서는 대전 ㈜풍림에서 구입한 활엽수 혼합 칩(아카시아: Robinia pseudoacacia L. 밤나무: Castanea crenata, 참나무: Quercus mongolica)을 공시재료로 사용하였다. 칩은 20-80 mesh로 분쇄하여 4℃에서 보관하였다. 시료의 구성성분은 글루칸 41.60±0.50%, 자일란 18.81±0.02%, 아라비난 2.11±0.03%, 총 리그닌 27.94±0.42%, 회분 0.41±0.02%, 추출물 1.32±0.05%, 아세틸기 3.62±0.23%였다.
2.2 바이오매스의 펜톤산화-열수처리
펜톤산화(Fenton oxidation: FO)는 선행연구에 의해 최적화된 펜톤시약 몰비(0.04 M FeSO4・7H2O: 1 M H2O2 (28%, w/w)=1:25)를 적용하였다[5,19]. 펜톤시약 90 mL와 전건무게 30 g의 바이오매스에 고액비 1:10이 되도록 증류수를 첨가하였다. 펜톤산화는 pH 3으로 조절하여 50℃, 150 rpm에서 1시간 동안 수행하였다. 반응 후 액상과 고형바이오매스로 분리하였으며 액상은 펜톤산화에 재사용하였다.
펜톤산화 후 회수된 용액은 펜톤산화에 재사용하기 위해 초기부피(90 mL)로 보정하였다. 부피 보정을 위해 증류수 또는 펜톤시약을 농도 별로 제조하여 첨가하였다. 보정된 펜톤산화 용액은 FO-RD(증류수로 보정), FO-R1(펜톤시약으로 보정), FO-R2(펜톤시약 농도를 2배로 하여 보정: 0.08 M FeSO4・7H2O, 2 M H2O2), FO-R3(펜톤시약 농도를 4배로 하여 보정: 0.16 M FeSO4・7H2O, 4 M H2O2)로 분류하였다. 펜톤시약 농도를 증가하여 첨가한 것은 펜톤산화 과정에서 손실된 펜톤시약을 보충하기 위함이다.
원시료와 펜톤산화 처리된 바이오매스 열수처리는 전건 무게 25 g의 바이오매스와 증류수를 1:8(w/w) 비율로 EMS 반응기(Mode EMV-HT/HP 600, Gyeonggi-do, Korea)에 첨가하여 170℃에서 10분 동안 150 rpm으로 교반하여 수행하였다.
2.3 펜톤산화 용액에 존재하는 Fe2+, OH 라디칼 및 H2O2 농도 분석
펜톤산화 용액에 존재하는 Fe2+ 농도는 ferrozine [3-(2-Pyridyl)-5,6-diphenyl-1,2,4-triazine-p,p′-disulfonic acid monosodium salt hydrate; Sigma Aldrich]를 이용하여 분석하였다[5,18]. 펜톤산화 용액(0.1 mL)과 10 mM의 ferrozine 용액 0.1 mL를 혼합하여 실온에서 10분 동안 반응하였다. Fe2+의 농도는 562 nm의 파장에서 UV-Vis spectrophotometer(JP/UV1800, Shimadzu, Japan)로 측정하였다. OH 라디칼 농도는 Fricke dosimetry를 이용하여 측정하였다[20]. Fricke 용액은 1 mM FeSO4, 0.4 M H2SO4, 1 mM NaCl을 혼합하여 제조하였다. OH 라디칼 농도는 펜톤산화 용액과 Fricke 용액을 혼합한 후 UV-Vis spectrophotometer를 이용하여 304 nm에서 측정하였다.
H2O2 농도는 iodometric titration에 의해 측정하였다[21,22]. 회수된 펜톤산화 용액(1 mL), 증류수(50 mL), 4% sulfuric acid 용액 (10 mL), 1%(w/v) KI 용액(10 mL), ammonium molybdate 용액(0.4 M, 50 μL)을 혼합한 후 sodium thiosulfate(0.1 N) 용액으로 적정하였다.
2.4 액상 및 고형바이오매스의 화학성분 분석
펜톤산화와 펜톤산화-열수처리 후 생성된 액상가수분해산물에 포함되어 있는 당 및 분해산물은 Aminex HPX-87H column(300 × 7.8 mm, Bio-Rad, Hercules, USA)과 refractive index detector(Waters 2414 system; Alliance, USA)가 장착된 HPLC(Waters 2695 system; Alliance, MA, USA)를 이용하여 분석하였으며, 이동상은 5 mM H2SO4, flow rate은 0.6 mL/min이었다[5]. Total phenolic compounds(TPC)의 함량은 Folin-Ciocalteu method를 이용하여 측정하였다[23]. 액상가수분해산물에 존재하는 올리고머를 확인하기 위해 National Renewable Energy Laboratory(NREL)의 방법에 따라 post-hydrolysis를 수행하였다[24]. 고형바이오매스의 구성성분은 NREL방법(Laboratory Analytical Procedure-Determination of structural carbohydrates and lignin in biomass)에 따라 분석하였다[25].
2.5 효소가수분해
전건시료 2 g을 삼각 플라스크에 투입한 후, 50 mM sodium citrate buffer(pH 4.8)을 사용하여 총 부피를 20 mL로 맞추고 121℃에서 15분간 멸균하였다. 효소는 Novozymes의 Cellic® CTec2(17.5 FPU/biomass(g))를 첨가하였고, 50℃, 150 rpm 조건에서 96시간 동안 효소가수분해를 수행하였다.
2.6 바이오매스의 구조적 특성
바이오매스의 구조적 특성은 fourier 변환 적외/근적외선 분광계(FT-IR/NIR) Spectrum 400(PerkinElmer, United Kingdom)를 이용하여 분석하였다. 스펙트럼은 4000-400 cm-1 범위에서 해상도 4 cm-1로 32 스캔하여 분석하였다. 결정화도 분석은 X’pert PRO Multi purpose X-ray Diffractometer(Panalitical, Netherland)를 이용하여 수행하였다. 분석은 2θ=5∼50° 범위에서 가속전압 40 kV, 30 m에서 측정하였다. 시료에 대한 결정성 영역은 Segal방법을 이용하여 계산하였다[26].
3. 결과 및 고찰
3.1 펜톤산화 용액의 재사용
펜톤산화 용액은 반응과정에서 생성되는 Fe2+, OH 라디칼, H2O2를 포함한다. 펜톤산화 후 회수된 용액에서 Fe2+과 H2O2는 검출되지 않았으나 0.11 mol/L의 OH 라디칼이 검출되었다. 이것은 펜톤산화에 의해 바이오매스와 펜톤시약 사이에 충분한 반응이 일어났음을 의미한다. 펜톤산화용액에 잔존하는 OH 라디칼은 바이오매스 분해를 유도하므로 펜톤산화에 재사용할 경우 바이오매스 가수분해에 효과적으로 작용할 것이다.
펜톤산화 후 액상에는 자일로스와 같은 소량의 헤미셀룰로오스 분해산물을 포함하고 있다(Table 1). pH는 아세트산과 같은 유기산 생성에 의해 감소하였으며(2.47), 이것은 최근 연구 결과와 일치하였다[5]. 최초 펜톤산화 조건(FO)은 펜톤산화 후 89.26%의 펜톤산화 용액 회수율을 나타냈으며, 재사용 후 최초의 조건과 유사한 90.12-92.55%를 나타냈다. 각 재사용 조건은 펜톤산화 시 펜톤산화 용액의 회수율을 고려하여 32 mL의 보정 용액을 첨가하였다. 펜톤산화 용액의 재사용 시 펜톤시약을 첨가할 경우(FO-R1, FO-R2, FO-R3) OH 라디칼 생성을 촉진할 수 있어 바이오매스 분해를 촉진할 것으로 예상하였으나 액상에 포함된 분해산물 사이에는 큰 차이를 나타내지 않았다. 리그닌 분해산물인 TPC는 펜톤산화 용액에 포함되어 있는 OH 라디칼에 의해 분해되어 정확한 농도를 측정할 수 없었다.
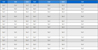
Sugar and degradation products in the liquid fraction and recovery yield of the liquid fraction obtained from Fenton oxidation of the biomass
펜톤산화 후 고형바이오매스는 원시료와 비교하여 일부 리그닌과 자일란의 분해가 일어났다(Fig. 1). 펜톤산화 용액 재사용의 경우 헤미셀룰로오스의 분해가 확인되었으나 원시료 함량과 큰 차이를 나타내지 않았다. 펜톤산화 용액 재사용에서 고형바이오매스 분해율은 초기 펜톤산화 조건(8.12%)에 비해 낮은 수준(4.97~5.59%)을 나타냈다. 그러나 펜톤시약 무첨가(control)와 비교하여 상대적으로 높은 분해율을 나타냈으며 증류수로 보정한 경우 다소 낮은 분해율을 나타냈다. 고농도의 펜톤시약을 첨가하였음에도 낮은 분해율을 나타낸 이유는 Fe 이온의 산화-환원을 위한 펜톤시약의 적절한 비율을 유지하지 못했기 때문으로 판단된다. 이러한 결과는 펜톤산화 용액에 포함된 OH라디칼이 바이오매스 분해에 기여함을 의미한다.

Chemical compositions of the raw material and Fenton oxidation treated biomass (RM; raw material, Control: reaction without Fenton’s reagent, FO; Fenton oxidation [19], FO-RD; adjustment with distilled water, FO-R1; adjustment with Fenton’s reagent, FO-R2; adjustment with 2X Fenton’s reagent, FO-R3; adjustment with 4X Fenton’s reagent)
바이오매스의 분해에 따른 작용기 변화는 FT-IR 분석에 기초하여 설명할 수 있다. 원시료와 펜톤산화 처리된 고형바이오매스의 FT-IR 스펙트럼에서 흡수 밴드가 공통적으로 확인되었다(Fig. 2). 펜톤산화 처리된 시료의 경우 원시료와 비교하여 셀룰로오스의 수소결합 및 결정성 셀룰로오스를 나타내는 3340 cm-1와 1030 cm-1영역에서 흡수피크가 증가하였다[27,28]. 이러한 피크의 변화는 헤미셀룰로오스 분해에 의한 상대적인 증가로 판단된다. 펜톤산화 용액 재사용 조건(FO-RD, FO-R1, FO-R2, FO-R3)에서 바이오매스 주요 구성성분에 대한 흡수피크의 변화는 최초 펜톤산화(FO) 처리 바이오매스와 비교하여 큰 변화를 나타내지 않았다. 재사용 조건에 대한 변화도 미미하였다.

FT-IR spectra of the raw material and Fenton oxidation treated biomass (RM; raw material, FO; Fenton oxidation [19], FO-RD; adjustment with distilled water, FO-R1; adjustment with Fenton’s reagent, FO-R2; adjustment with 2X Fenton’s reagent, FO-R3; adjustment with 4X Fenton’s reagent)
Fig. 3은 고형바이오매스의 결정화도 결과이다. 원시료(39.23%)와 비교하여 펜톤산화 후 결정화도(40.97-46.87%)는 증가하였다. 펜톤산화에 의한 헤미셀룰로오스 분해는 결정성영역을 상대적으로 증가시킬 수 있다[4]. 펜톤산화 용액 재사용(FO-RD, FO-R1, FO-R2, FO-R3)에서는 원시료보다 결정화도가 증가하였으나 최초 펜톤산화 처리 (FO)와 비교하여 다소 낮은 값을 나타냈다. 이러한 경향은 FT-IR 결과와 일치하였다.
3.2 바이오매스의 펜톤산화-열수처리
바이오매스의 분해를 촉진하기 위해 펜톤산화 후 열수처리를 수행하였다. 일반적으로 열수처리 과정에서 바이오매스는 물 분자와 수소이온이 결합하여 묽은 산 역할을 수행하는 하이드로늄 이온에 의해 가수분해되며, 반응 공정 중 바이오매스로부터 생성된 유기산에 의해 약산성 조건으로 전환됨에 따라 가수분해가 촉진된다[29]. 펜톤산화에 의해 1차적으로 분해된 바이오매스는 원시료의 열수처리와 비교하여 순차적인 열수처리를 수행할 경우 향상된 가수분해 효율을 기대할 수 있다. 원시료-열수처리(RM-HT), 펜톤산화-열수처리(FO-HT, FO-RD-HT, FO-R1-HT, FO-R2-HT, FO-R2-HT)를 수행하여 펜톤산화에 의한 바이오매스 분해 촉진을 확인하였다. 바이오매스 열수처리 후 생성된 액상가수분해산물의 성분분석 결과는 Table 2와 같다. 자일로스는 액상가수분해산물의 주요성분으로 최초 펜톤산화 조건(FO)에서 가장 높은 농도(16.51 g/L)로 검출되었다. 펜톤산화 없이 열수처리를 수행하였을 때(RM-HT) 자일로스는 2.72 g/L로 펜톤산화에 의해 바이오매스 분해가 촉진되었음을 확인하였다. 이것은 선행연구 결과와 일치하였으며, 펜톤산화-열수처리에 의해 헤미셀룰로오스가 효과적으로 제거되었음을 의미한다[5]. 펜톤산화 용액 재사용 조건의 열수처리 후 액상가수분해산물에는 최초 펜톤산화 조건(FO-HT)과 비교하여 낮은 농도의 당과 분해산물을 포함하였다. 펜톤산화 용액의 재사용으로부터 최초 펜톤산화(FO-HT) 분해 효과를 기대하기 어려우나 재사용할 경우 효과적인 바이오매스 분해를 유도하는 것으로 나타났다. 펜톤산화 용액은 재사용 시 첨가된 증류수 및 펜톤시약 농도에 따라 분해산물 농도의 차이를 나타냈다. 증류수가 첨가된 FO-RD-HT은 자일로스의 분해를 촉진하였다. 반면 펜톤시약이 첨가된 조건에서는 리그닌 분해산물인 TPC의 농도가 상대적으로 높았다. 이것은 펜톤산화 과정에서 OH 라디칼의 생성을 촉진시켜 방향족 화합물인 리그닌을 효과적으로 분해한 것으로 판단된다[30].

Sugars and degradation products in the hydrolysate during hydrothermal treatment of the raw material and Fenton oxidation treated biomass
열수처리 과정에서 생성되는 하이드로늄 이온은 자일란을 불규칙적으로 분해하여 낮은 중합도를 가지는 자일로-올리고당을 생성한다[31~33]. 펜톤산화-열수처리(FO-HT)과정에서는 올리고당이 생성되지 않았다. 이것은 펜톤산화 처리 바이오매스로 열수처리를 수행한 결과 대부분 단당류로 변환되었음을 의미한다. 펜톤산화를 수행하지 않고 열수처리만 수행했을 경우(RM-HT) 높은 농도의 자일로-올리고당(7.66 g/L)을 생성하였다. 반면 펜톤산화 용액을 재사용하여 열수처리를 수행한 결과 상대적으로 낮은 농도의 자일로-올리고당을 생성하였다(1.53-4.78 g/L). 펜톤산화 용액 재사용 조건에 따라 차이를 나타냈으며 펜톤산화 용액 재사용을 위해 고농도의 펜톤시약으로 조정한 경우(FO-R2-HT, FO-R3-HT) 자일로-올리고머 함량이 상대적으로 높았다(4.60-4.78 g/L). 재사용된 펜톤산화 용액은 최초 펜톤산화 용액을 대체할 수 없으나 펜톤산화 없이 열수처리(RM-HT) 조건과 비교하여 뚜렷한 가수분해효과를 나타냈다.
Fig. 4는 원시료와 펜톤산화 처리된 고형바이오매스의 열수처리 후 구성성분 분석결과이다. 최초 펜톤산화-열수처리(FO-HT) 조건에서 34.75%의 가장 높은 분해율을 나타냈다. 펜톤산화 용액 재사용 후 열수처리의 분해율(29.24-31.05%)은 FO-HT 조건에 비해 상대적으로 감소하였다. 하지만 펜톤산화 처리 없이 열수처리를 수행한 경우(RM-HT:15.21%)보다 약 2배 이상의 분해 효과를 나타냈다. 열수처리에 의해 헤미셀룰로오스가 선택적으로 분해되므로 분해율이 높을수록 자일란의 함량이 감소하였고 상대적으로 글루칸과 리그닌의 함량이 증가하였다. 이것은 Table 2의 결과와 일치하였다.

Chemical compositions of hydrothermal treated biomass (RM-HT; hydrothermal treatment with raw material, FO-HT; hydrothermal treatment after Fenton oxidation[19], FO-RD-HT; hydrothermal treatment after Fenton oxidation using Fenton oxidation solution adjusted with distilled water, FO-R1-HT; hydrothermal treatment after Fenton oxidation using Fenton oxidation solution adjusted with Fenton’s reagent, FO-R2-HT; hydrothermal treatment after Fenton oxidation using Fenton oxidation solution adjusted with 2X Fenton’s reagent, FO-R3-HT; hydrothermal treatment after Fenton oxidation using Fenton oxidation solution adjusted with 4X Fenton’s reagent)
3.3 효소가수분해
펜톤산화-열수처리 바이오매스를 이용한 효소가수분해 결과는 Fig. 5와 같다. 펜톤산화 없이 열수처리 한 경우(RM-HT) 96시간 후 32.05%의 셀룰로오스 전환율을 나타냈다. 열수처리만으로 효소가수분해 효율을 향상시키지 못 하였다. 최초 펜톤산화 후 열수처리(FO-HT)에서는 89.64%의 셀룰로오스 전환이 이루어졌지만 펜톤산화 용액 재사용(72.40~74.84%)에서는 FO-HT 수준에 미치지 못하였다. 하지만 펜톤산화 없이 열수처리 한 경우와 비교하여 상대적으로 높은 셀룰로오스 전환율을 나타냈다. 펜톤산화 용액은 재사용 조건에 따라 효소가수분해 수율에 큰 차이를 나타내지 않았다. 펜톤산화 용액 재사용을 위해 부피보정으로 증류수, 농도가 다른 펜톤시약을 사용하였으나 펜톤산화 후 수행되는 열수처리, 효소가수분해 결과를 종합하면 증류수, 펜톤시약 농도에 따른 차이는 뚜렷하지 않았다. 펜톤산화, 열수처리에서는 펜톤시약의 농도가 증가할수록 분해율이 다소 증가하였으나 효소가수분해에서는 큰 차이를 나타내지 않았다. 이것은 회수된 펜톤산화 용액에 펜톤시약 첨가 없이 재사용이 가능하며 펜톤산화 용액 내에 존재하는 OH 라디칼이 바이오매스 분해에 기여할 수 있다는 것은 의미한다.

Enzymatic hydrolysis of hydrothermal treated biomass (RM-HT; hydrothermal treatment with raw material, FO-HT; hydrothermal treatment after Fenton oxidation[19], FO-RD-HT; hydrothermal treatment after Fenton oxidation using Fenton oxidation solution adjusted with distilled water, FO-R1-HT; hydrothermal treatment after Fenton oxidation using Fenton oxidation solution adjusted with Fenton’s reagent, FO-R2-HT; hydrothermal treatment after Fenton oxidation using Fenton oxidation solution adjusted with 2X Fenton’s reagent, FO-R3-HT; hydrothermal treatment after Fenton oxidation using Fenton oxidation solution adjusted with 4X Fenton’s reagent)
4. 결 론
펜톤산화 용액의 재사용 조건은 초기 펜톤산화-열수처리 조건과 비교하여 낮은 가수분해 및 효소가수분해 수율을 나타냈다. 그러나 단일 열수처리와 비교하여 재사용 조건에서 상대적으로 우수하였다. 이것은 펜톤산화 용액의 재사용 가능성을 증명하는 결과이며 재사용 펜톤산화 용액에 포함된 OH 라디칼을 가수분해의 촉진 인자로 고려할 수 있다. 펜톤산화 용액의 재사용은 초기 펜톤산화 분해 정도에 도달하지 못하였으며 초기 펜톤산화-열수처리 효율을 회복하기 위해 펜톤시약이 추가되었으나 그 효과는 미미하였다. 그러나 펜톤산화 용액의 재사용은 펜톤 시약의 사용량을 최소화하여 공정의 전체 비용을 감소시킬 수 있다. 본 연구의 펜톤산화 용액 재사용 기술은 경제적인 측면에서 목질계 바이오매스로부터 바이오연료 및 바이오 기반 화학 물질 생산의 비용 절감 시스템을 구축하기 위한 기초연구가 될 것이다.
Acknowledgments
이 논문은 전남대학교 연구년 교수 연구비(과제번호: 2016-2418) 지원에 의하여 연구되었습니다.
References
-
Ahmed, M.A., Seo, Y.H., Terán-Hilares, R., Rehman, M.S.U.R., and Han, J.-I., 2016, “Persulfate based pretreatment to enhance the enzymatic digestibility of rice straw”, Bioresour. Technol., 222, 523-526.
[https://doi.org/10.1016/j.biortech.2016.09.122]

-
Haykir, N.I., Bahcegul, E., Bicak, N., and Bakir, U., 2013, “Pretreatment of cotton stalk with ionic liquids including 2-hydroxy ethyl ammonium formate to enhance biomass digestibility”, Ind. Crops Prod., 41, 430-436.
[https://doi.org/10.1016/j.indcrop.2012.04.041]

-
Jönsson, L.J., and Martín, C., 2016, “Pretreatment of lignocellulose: Formation of inhibitory by-products and strategies for minimizing their effects”, Bioresour. Technol., 199, 103-112.
[https://doi.org/10.1016/j.biortech.2015.10.009]

-
Jeong, S.-Y., and Lee, J.-W., 2016, “Optimization of pretreatment condition for ethanol production from oxalic acid pretreated biomass by response surface methodology”, Ind. Crops Prod., 79, 1-6.
[https://doi.org/10.1016/j.indcrop.2015.10.036]

-
Jeong, S.-Y., and Lee, J.-W., 2016, “Sequential Fenton oxidation and hydrothermal treatment to improve the effect of pretreatment and enzymatic hydrolysis on mixed hardwood”, Bioresour. Technol., 200, 121-127.
[https://doi.org/10.1016/j.biortech.2015.10.015]

-
W., and Zhu, D., 2017, “Enzymatic saccharificationresponses of Eichhornia crassipes, sugarcane bagasseand Metasequoia glyptostroboides to two oxidationpretreatments for biofuel production”, Ind. Crops Prod.,107, 22-29.
[https://doi.org/10.1016/j.indcrop.2017.05.017]

-
Song, Y., Jiang, W., Zhang, Y., Ben, H., Han, G., and Ragauskas, A.J., 2018, “Isolation and characterization of cellulosic fibers from kenaf bast using steam explosion and Fenton oxidation treatment”, Cellulose, 25, 4979-4992.
[https://doi.org/10.1007/s10570-018-1916-y]

-
Zhang, Y., Liang, J., Zhou, W., and Xiao, N., 2019, “Comparison of Fenton and bismuth ferrite Fenton-like pretreatments of sugarcane bagasse to enhance enzymatic saccharification”, Bioresour. Technol., 285, 121343.
[https://doi.org/10.1016/j.biortech.2019.121343]

-
He, Y.-C., Ding, Y., Xue, Y.-F., Yang, B., Liu, F., Wang, C., Zhu, Z.-Z., Qing, Q., Wu, H., Zhu, C., et al., 2015, “Enhancement of enzymatic saccharification of corn stover with sequential Fenton pretreatment and dilute NaOH extraction”, Bioresour. Technol., 193, 324-330.
[https://doi.org/10.1016/j.biortech.2015.06.088]

- Zhang, C., Pei, H., Wang, S., Cui, Z., and Liu, P., 2016, “Enhanced enzymatic hydrolysis of poplar after combined dilute NaOH and Fenton pretreatment”, BioRes., 11(3), 7522-7536.
-
Yu, M., Chang, S., Li, D., Zhang, C., Jiang, L., Han, Y., Qi, L., Li, J., and Li, S., 2017, “A comparison of NaOH, Fenton, and their combined pretreatments for improving saccharification of corn stalks”, Energy Fuels, 31(10), 10983-10989.
[https://doi.org/10.1021/acs.energyfuels.7b02217]

- Arantes, V., and Goodell, B., 2014, “Current understanding of brown-rot fungal biodegradation mechanisms: a review”, In: Schultz, T. (ed.), “Deterioration and protection of sustainable biomaterials”, ACS Publications, Washington DC, 3-21.
-
Sanchez, A., Gil, J.C., Rojas-Rejón, O.A., de Alba, A.P., Medina, A., Flores, R., and Puente, R., 2015, “Sequential pretreatment strategies under mild conditions for efficient enzymatic hydrolysis of wheat straw”, Bioproc. Biosyst. Eng., 38(6), 1127-1141.
[https://doi.org/10.1007/s00449-015-1355-1]

-
Alencar, B.R.A., Reis, A.L.S., de Souza, R.d.F.R., Morais Jr, M.A., Menezes, R.S.C., and Dutra, E.D., 2017, “Recycling the liquid fraction of alkaline hydrogen peroxide in the pretreatment of corn stover”, Bioresour. Technol., 241, 928-935.
[https://doi.org/10.1016/j.biortech.2017.06.022]

- Tran, A.T., Cao, N.H., Le, P.T.K., Mai, P.T., and Nguyen, Q.D., 2020, “Reusing alkaline solution in lignocellulose pretreatment to save consumable chemicals without losing efficiency”, Chem. Eng. Trans., 78, 307-312.
-
Rocha, G.J.M., Nascimento, V.M., da Silva, V.F.N., Corso, D.L.S., and Gonçalves, A.R., 2014, “Contributing to the environmental sustainability of the second generation ethanol production: delignification of sugarcane bagasse with sodium hydroxide recycling”, Ind. Crop. Prod., 59, 63-68.
[https://doi.org/10.1016/j.indcrop.2014.05.002]

-
Wang, W., Chen, X., Tan, X., Wang, Q., Liu, Y., He, M., Yu, Q., Qi, W., Luo, Y., Zhuang, X., et al., 2017, “Feasibility of reusing the black liquor for enzymatic hydrolysis and ethanol fermentation”, Bioresour. Technol., 228, 235-240.
[https://doi.org/10.1016/j.biortech.2016.12.076]

-
Jung, Y.H., Kim, H.K., Park, H.M., Park, Y.-C., Park, K., Seo, J.-H., and Kim, K.H., 2015, “Mimicking the Fenton reaction-induced wood decay by fungi for pretreatment of lignocellulose”, Bioresour. Technol., 179, 467-472.
[https://doi.org/10.1016/j.biortech.2014.12.069]

-
Jeong, S.-Y., and Lee, J.-W., 2020, “Catalytic effect of iron on sequential Fenton oxidation, hydrothermal treatment, and enzymatic hydrolysis to produce monosaccharide from lignocellulosic biomass”, Ind. Crops Prod., 158, 112953.
[https://doi.org/10.1016/j.indcrop.2020.112953]

-
Ramadoss, G., and Muthukumar, K., 2015, “Influence of dual salt on the pretreatment of sugarcane bagasse with hydrogen peroxide for bioethanol production”, Chem. Eng. J., 260, 178-187.
[https://doi.org/10.1016/j.cej.2014.08.006]

- Peroxide, U., 2003, “Methods for residual peroxide determination: iodometric titration”, https://www.h2o2.com/technical-library/analytical-methods/default.aspx?pid=70&name=Iodometric-Titration, .
- Benatti, C.T., and Tavares, C.R.G., 2012, “Fenton‘s process for the treatment of mixed waste chemicals”. In: Puzyn, T., and Mostrag-Szlichtyng, A. (eds.), “Organic pollutants ten years after the Stockholm convention-Environmental and analytical update”, InTech, Rijeka, 247-270.
-
Scalbert, A., Monties, B., and Janin, G., 1989, “Tannins in wood: comparison of different estimation methods”, J. Agric. Food Chem., 37(5), 1324-1329.
[https://doi.org/10.1021/jf00089a026]

-
Jensen, J.R., Morinelly, J.E., Gossen, K.R., Brodeur-Campbell, M.J., and Shonnard, D.R., 2010, “Effects of dilute acid pretreatment conditions on enzymatic hydrolysis monomer and oligomer sugar yields for aspen, balsam, and switchgrass”, Bioresour. Technol., 101(7), 2317-2325.
[https://doi.org/10.1016/j.biortech.2009.11.038]

- Sluiter, A., Hames, B., Ruiz, R., Scarlata, C., Sluiter, J., Templeton, D., and Crocker, D., 2008, “Determination of structural carbohydrates and lignin in biomass”, National Renewable Energy Laboratory, Golden, CO.
-
Segal, L., Creely, J.J., Martin Jr, A.E., and Conrad, C.M., 1959, “An empirical method for estimating the degree of crystallinity of native cellulose using the X-ray diffractometer”, Tex. Res. J., 29(10), 786-794.
[https://doi.org/10.1177/004051755902901003]

- Chen, Y., Tang, J., and Ju, J., 2015, “Conductive polypyrrole composited PET and cotton fabrics with alkali treatment”, Proceedings of the 2014 International Conference on Materials Science and Energy Engineering (CMSEE 2014), 135-141.
-
Flores-Velázquez, V., Córdova-Pérez, G.E., Silahua-Pavón, A.A., Torres-Torres, J.G., Sierra, U., Fernández, S., Godavarthi, S., Ortiz-Chi, F., and Espinosa-González, C.G., 2020, “Cellulose obtained from banana plant waste for catalytic production of 5-HMF: Effect of grinding on the cellulose properties”, Fuel, 265, 116857.
[https://doi.org/10.1016/j.fuel.2019.116857]

- Jeong, S.Y., and Lee, J.W., 2015, “Hydrothermal treatment”, In: Pandey, A., Negi, S., Binod, P., and Larroche, C. (Eds.), “Pretreatment of Biomass: Processes and Technologies”, Elsevier, Amsterdam, 61-74.
-
Soudham, V.P., Brandberg, T., Mikkola, J.-P., and Larsson, C., 2014, “Detoxification of acid pretreated spruce hydrolysates with ferrous sulfate and hydrogen peroxide improves enzymatic hydrolysis and fermentation”, Bioresour. Technol., 166, 559-565.
[https://doi.org/10.1016/j.biortech.2014.05.096]

-
Chen, X., Lawoko, M., and Heiningen, A.v., 2010, “Kinetics and mechanism of autohydrolysis of hardwoods”, Bioresour. Technol., 101(20), 7812-7819.
[https://doi.org/10.1016/j.biortech.2010.05.006]

-
Jeong, S.Y., and Lee, J.W., 2019, “Analysis of affecting factors on ethanol fermentation of hydrolysate derived from oxalic acid pretreatment of yellow poplar (Liriodedron tulipifera)”, New. Renew. Energy, 15(4), 75-85.
[https://doi.org/10.7849/ksnre.2019.12.15.4.075]

-
Lee, Y.J., Choi, J.H., Jeong, S.Y., and Lee, J.W., 2019. “Evaluation of the reuse of the hydrolysate generated from an empty fruit bunch hydrothermal pretreatment”, New. Renew. Energy, 15(2), 52-60.
[https://doi.org/10.7849/ksnre.2019.6.15.2.052]


