음폐수의 혐기성 소화 시 수소 및 유기산의 거동
Copyright © 2022 by the New & Renewable Energy
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In this study, we used the Flux Balance Analysis (FBA) program to examine the behavior of hydrogen and organic acids according to seasonal changes in food wastewater collected from D city. The results showed that average hydrogen conversion rates in spring, summer, autumn, and winter were 1.06, 0.71, 1.21, and 1.13 mol H2/mol of hexoseadded, respectively, indicating a significantly lower hydrogen conversion rate in summer than in other seasons. This phenomenon is believed to occur because the carbohydrate concentration of the incoming food wastewater is low. In addition, Lactobacillus, the lactic acid-producing bacterium, was 21.3% in spring, 27.2% in summer, 17.5% in autumn, and 22.6% in winter. The most distinctive feature of the microbial community in summer was that 15.3% of the Ilyobacter was analyzed. It was confirmed that Ilyobacter, which is involved in the production of acetic acid and propionic acid, is closely associated with the tendency of increasing acetic acid and propionic acid and thus contributes to organic acid change. Clostridium, a hydrogen-producing bacterium, was 76.2%, 50.8%, 78.3%, and 74%, in spring, summer, autumn, and winter, respectively. It was confirmed that Clostridium dominates the microbial community by approximately 70% or more in all seasons except summer.
Keywords:
Food Wastewater, Anaerobic digestion, Hydrogen, Organic acid, Microbial community키워드:
음폐수, 혐기성 소화, 수소, 유기산, 미생물군집1. 서 론
음식물류폐기물의 자원화 과정에서 발생되는 탈리액인 음폐수는 음식물류폐기물의 자원화를 위해 전처리 과정에서 탈수 또는 염분 희석을 위한 세척 등으로 인하여 발생하게 된다.[1] 음폐수에 대한 정의는 음식물류폐기물 처리과정에서 발생되는 탈리액으로 단순하게 정의할 수 있지만 각 공정별로 음폐수의 발생을 고려하여 정의 및 범위를 설정할 필요가 있을 것으로 판단된다.[2] 음폐수에 대한 육상처리 관련 문제가 환경적 이슈로 대두된 2000년대 초반 이후 음폐수와 관련한 용어는 ‘음식물 탈리액’, ‘음식물 침출수’, ‘음식물 폐수’ 등 다양하게 사용되어져 왔지만 최근 들어 음식물 폐수를 줄여 ‘음폐수’ 라는 용어가 표준시 되고 있으며,[3] 각기 다양한 용어의 개념을 떠나 일반적으로 음식물류폐기물 처리과정에서 발생되는 고농도 폐수를 의미한다. 현재 자원화시설에서 발생되는 폐수는 침출수, 탈리액 및 소화/탈수여액 등으로 구분되며, 여기서 침출수란 음식물류폐기물을 자원화시설로 운반 후 반입조에 투입하여 전처리시설로 옮겨지게 되는데 반입조 에서 전처리시설로 옮겨지기 전까지 음식물류폐기물에서 발생되는 폐수를 침출수라 말하며, 이송과정 및 파쇄/선별시설에서 발생되는 폐수 역시 침출수라고 말한다. 탈리액은 전처리시설인 탈수 및 세척과정에서 발생되는 폐수를 말한다. 이와 같이 음식물류폐기물 처리시설에서는 처리공정 내에서 침출되거나, 탈리되는 폐수, 분해되지 않은 고농도의 폐수 또는 사료화 공정의 하부 침출수 및 응축수 등의 폐수가 발생된다. 따라서 음폐수에 대한 정의 및 범위를 재설정하면 ‘음폐수’라 함은 ‘음식물류폐기물 전처리 과정에서 침출, 탈리되는 폐수 및 자원화시설 본 처리과정에서 침출, 증발, 분해에 의하여 발생되는 폐수’라고 정의 내릴 수 있다.[4] 음식물 자원화시설의 운영에 있어서 음폐수가 많이 발생한 것은 음식물류폐기물이 갖고 있는 염분문제와 수분에 의한 건조 에너지 소비 등의 문제를 해결하고자 탈수 등의 전처리 과정에서 수분을 많이 제거하기 때문이며, 이는 사료 및 퇴비로 재활용하는 시설에서 발생되는 자연스런 현상에서 이의 처리방법에 대한 관심이 증가되고 있는 추세이다.
2016년 음식물류폐기물 처리시설 설치 운영 현황자료를 분석한 결과 음식물류폐기물 처리시설에서 발생한 총 음폐수는 55,102 톤/일로 공공시설에서 30,803 톤/일로 전체 발생량의 56%, 민간시설에서 24,299 톤/일로 44%가 발생하였는데, 공공처리시설의 경우 이 중 55.7%인 754천 톤/년이 바이오가스화 처리되었다. 이는 민간시설에서 발생되는 음폐수를 포함한 총 음폐수 발생량으로 계산하면 30% 정도가 바이오가스화로 처리된다고 볼 수 있다. 우리나라에 보급된 혐기성소화방식은 대부분 습식소화방식이며,[5]바이오가스화는 혐기성 소화를 통하여 폐기물 및 폐수로부터 메탄가스를 회수하는 메탄소화가 주요하였지만, 최근들어 유기물의 메탄가스로의 전환을 부분적으로 차단하여 부가가치가 높은 수소를 생산하는공정 연구가 활발히 진행되고 있는 실정이다.
따라서 본 연구에서는 음식물류폐기물의 전처리과정에서 발생되는 음폐수를 이용하여 계절변화에 따른 혐기성 수소 발효를 파이롯트 규모로 운전하고, FBA(Flux Balance Analysis)프로그램을 이용하여 수소 및 유기산의 거동을 확인하고자 하였으며, 추가적으로 미생물 군집변화를 통하여 유기산 생성과의 상관관계를 고찰하고자 하였다.
2. 연구재료 및 방법
2.1 음폐수의 성상
본 실험에 사용된 음폐수는 D시 환경사업소 자원화시설에서 채취하여 사용하였다. 수거된 음폐수는 1차적으로 플라스틱, 실, 씨앗, 비닐, 뼈와 같이 처리에 적합하지 않은 것들을 선별한 후 2차 파쇄기를 통하여 온도 10℃ 이하의 냉장 저장조에 보관하여 적용하였고 음폐수의 성상은 Table 1에 나타내었다.
2.2 실험장치 및 운전조건
실험 장치는 수소 발효 운전을 위한 파이롯트 규모로 임펠러 방식의 교반설비가 설치된 원통형이며 총 용적은 1.4 m3(유효용적 1 m3)이고, 가온부분에 있어서는 온수를 반응기 자켓에 순환시켜 중온 조건 35℃를 유지하였다. 반응기 상부에 상, 중, 하 지점에 pH sensor를 설치하여 지속적인 pH를 관찰하였다. 수소 발효가 진행되는 동안 생성된 바이오가스 발생량을 가스 측정기를 이용하여 확인하였다. 또한 자동계측 프로그램을 추가하여 지속적으로 관찰하였다. 또한 본 실험은 별 다른 식종균을 투입하지 않고, 음폐수 자체 내의 Clostridium sp. 계열의 미생물을 이용하였다.[6,7] 수소생산에 저해되는 종균의 사멸을 위해 HCl을 사용하여 pH를 2로 낮추고 약 12시간 동안 상온에서 100 rpm 교반하여 전처리 하였다. 전처리가 끝난 후 10 N KOH를 사용하여 초기 pH 8로 조절하였고, 반응기 내부는 질소 치환하여 혐기상태로 수소 발효를 시작하였다. 수소 발효가 진행되는 동안 유기산 생성에 의한 pH 저하 및 유지를 위하여 KOH를 사용하여 pH 5.5±0.2으로 유지하였다. 수소 발효 기간에는 100 rpm으로 교반하여 운전하였다.
2.3 분석방법
본 실험에 사용된 음폐수의 TCOD(total chemical oxygen demand), TS(total solids), VS(volatile solids)는 수질공정시험법에 따라 분석하였다.[8] 탄수화물 측정은 페놀-황산법을 사용하였으며 분석방법은 2 mL의 시료에 황산 5 mL, 페놀 1 mL를 첨가하고 30분간 반응시킨 후 spectrophotometer (DR/2010; Hach Co., USA)를 사용하여 490 nm 파장에서 흡광도를 측정하였다. 온도조건은 injector 80℃, column 50℃, detector 90℃로 하였고 질소(99.999%)를 carrier gas로 하여 분석하였다. 발생된 수소 발효액의 유기산 농도는 수소 발효가 진행되는 동안 주기적으로 샘플을 추출하여 증류수와 희석하고 상등액을 0.2 ㎛ 막으로 여과 후 HPLC (Model VP, Shimadzu CO., Japan)를 이용하여 분석하였다. 검출기는 Ultraviolet(215 nm) detector(UV 100, Thermo Electron)가 사용되었고 column은 300 mm × 7.8 mm Aminex HPX-87H, 60℃로 분석하였다. Mobile phase는 5 mM H2SO4이었으며 이동속도는 0.6 mL/min이었다.
또한 본 연구에서는 유기산 생산 공정의 외부 생산물을 기준으로 내부에서의 플럭스 흐름을 파악하기 위해 Flux Balance Analysis(FBA)를 이용하였으며, 미생물의 분석을 위해 반응조 내 샘플을 Ultraclean Soil DNA Kit (Cat #12800-50; Mo Bio Laboratory Inc, USA)을 이용하여 추출하였고 추출한 DNA는 Ultralclean Microbial DNA Isolation Kit (Mo Bio Laboratories, CA, USA)를 이용하여 정제하였다. 그리고 GS FLX tianium library prep guide에 따라 분류하고 분류된 library는 Picogreen assay(Victor 3)에 의해 정량하였다. 27F(5’ 16S GAGTTTGATCMTGGCTCAG 3’)와 800R(5’ TACCAGGGTATCTAATCC 3’)의 16S universal 프라이머를 이용하여 16s rRNA gene로 증폭하였다. PCR 반응 이후에는 AMPure beads(Beckman coulter)를 이용하여 정성분석한 뒤에 시퀀싱은 454 pyrosequencing Genome Sequencer FLX Titanium(Life Science, CT, USA)를 이용하여 분류하였다.
3. 연구결과 및 고찰
3.1 수소발생 및 탄수화물 제거
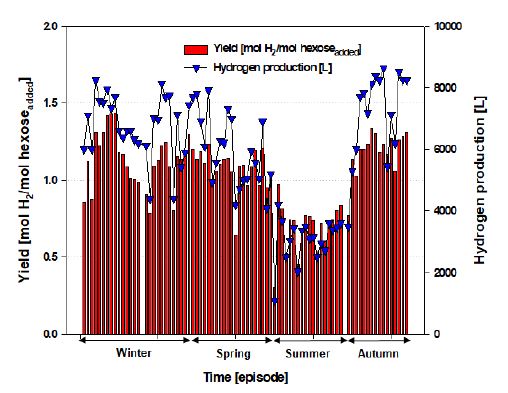
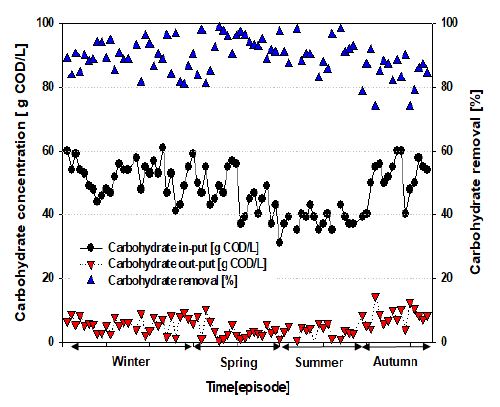
본 연구에 사용된 음폐수는 D시 전 지역에서 수거되는 것으로 실험실 규모의 연구에서 얻어진 수소 발효의 최적 운전 인자를 적용하고,[9] 파이롯트 규모의 설비를 구축하여 계절 변화에 따른 수소발생량, 전환율, 유기산 농도 등의 변화를 장기간 관찰하였다. 먼저 계절변화에 따른 수소발생량과 전환율을 Table 2와 Fig. 1에 나타내었다. 결과를 살펴보면 봄, 가을, 겨울의 경우 평균 전환율은 1.06∼1.21 mol H2/mol hexoseadded로 나타났다. 반면에 여름철의 경우 다른 계절 대비 약 50% 낮은 0.711 mol H2/mol hexoseadded의 전환율을 나타내었다. 이는 Fig. 2에서와 같이 투입되는 음폐수의 낮은 탄수화물 농도에 기인한 것으로 사계절 각각의 탄수화물 함량은 봄 33.8%, 여름 25.3%, 가을 31.8%, 겨울 36.1%으로 확인되었다. 그러나 봄, 여름, 가을, 겨울의 탄수화물 제거율은 약 90%으로 유사하게 나타났다. 이론적 수소발생량은 1 mol의 포도당으로부터 12 mol의 수소가 생성된다. 이를 기준으로 수소 전환 효율은 봄 3.1%, 여름 1.49%, 가을 3.22%, 겨울 3.4%로 음폐수의 탄수화물 농도 대비 겨울철이 가장 높은 것으로 나타났다. 이 결과를 실험실 규모의 음식물류 폐기물을 이용한 선행실험에서의 수소 전환율은 1.65 mol H2/mol hexoseadded 와 비교해보면[9] 다소 낮은 전환율을 나타냈으며, 이는 실혐실 규모의 실험과 다른 음식물류 폐기물의 성상 차이와 수거/운반 과정에서 특히 여름철의 높은 온도로 인한 탄수화물의 가수분해에 따른 결과라 여겨지며 신속수거체계 마련이 필요해 보인다. 또한 기존의 실 폐수로부터의 수소 생산 연구로서 그 사례가 순수 기질을 이용한 연구에 비해 극히 적지만, 음식물 쓰레기 침출수를 기질로 하여 iron dust를 첨가한 고온 ASBR을 이용하여 HRT 3일, 55℃, pH 5.2조건에서 2.08 mol H2/mol hexose의 높은 수소 전환율을 보였다.[10] 이와 같이 실제 폐수를 이용한 수소 생산의 적용 가능성은 볼 수 있지만 기본적으로 성공적인 수소 생산을 위해서는 기질 내의 탄수화물 구성비가 높아야 하며, 폐수 내에 포함된 비 수소 생성균에 의한 저해작용을 줄여야 하며, 특정 공장 폐수 사용 시 예측하지 못했던 현상들이 일어날 수 있다. 따라서 보다 많은 실제 폐수를 기질로 적용하여 다양한 환경 인자 변화를 통한 효율적인 수소 생산에 관한 연구는 반드시 이루어져야 한다.
3.2 유기산 변화
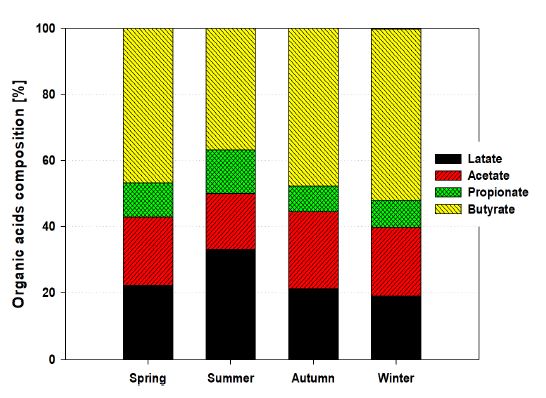
음폐수의 초기 탄수화물 농도 기준 약 40 g carbo. COD/L에서는 생성된 유기산을 Fig. 3에 나타내었다. 그 결과를 살펴보면 수소생산과 직접적인 관련이 있는 butyrate의 비율이 4계절 평균 19.8 g COD/L로 총 발생 유기산 중 butyrate농도가 약 50%의 비율을 나타내었다. 그러나 여름철의 경우 수소생산량과 비례하게 13.5 g COD/L으로 가장 낮았으며, lactate 농도는 11.7 g COD/L로 33.1%를 차지하는 것으로 나타났다. 또한 수소발효 시 butyrate/acetate (B/A) 비율이 수소발생량과 비례한다고 보고되고 있으며, 이는 수소발효에서 acetate보다 butyrate의 생성이 상대적으로 많아야 수소생산이 유리하다는 것을 의미한다. 기존 문헌에서도 butyrate/acetate의 비율이 2∼4일 때, 수소생산이 가장 활발한 것으로 보고되어져 있다.[11,12] 본 실험에서는 2.25, 2.25, 2.04, 2.47 평균 2.25로 나타났다. 이러한 결과로 볼 때 음폐수를 이용한 수소발효의 성능이 안정적으로 이루어진 것으로 판단된다.
3.3 FBA(Flux Balance Analysis)이용한 수소 및 유기산 거동
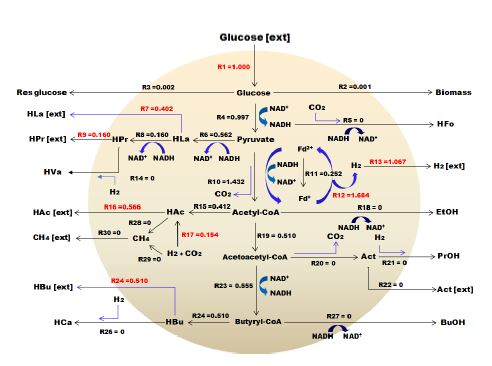
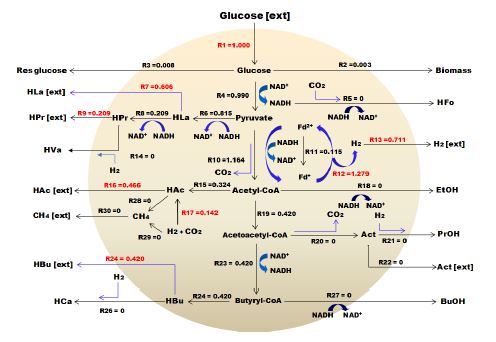
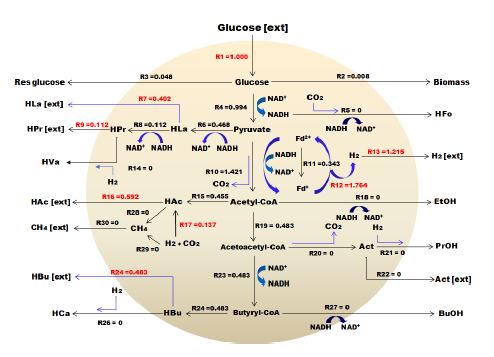
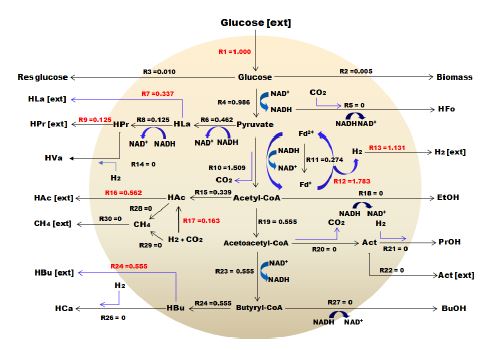
Flux 흐름 분석은 전자 또는 탄소 플럭스 분포 패턴을 분석하고 유기산, 아미노산, 다당류 및 항생제와 같은 생산물의 수율을 극대화하는 데 널리 사용되는 기본 접근방법이다. 시스템 내에서의 대사 생리학을 정량화하고 실험 데이터를 시뮬레이션 및 해석하며 대사공학을 위한 경로를 분석하고 생물 공정을 최적화하는데 유용한 도구로 사용되어져 왔다. FBA 프로그램의 몰 흐름도는 30 × 30 매트릭스로 이루어져 있는데, 이는 시스템 내에서 가능한 반응을 구분한 것으로 Table 3에 나타낸 바와 R1에서 R30까지 총 30개로 이루어져 있다.
총 30개의 반응은 14개의 세포 내 반응(intra-cellular reaction)과 16개의 세포 외 반응(extra-cellular reaction)으로 구성되는데 예를 들어, HAc는 아세트산으로 세포 내 반응을 통해 생산된 물질을 의미하지만 HAc(ext)는 세포 외로 유출되는 아세트산을 의미한다. Flux 흐름도는 음식물류폐기물의 수소발효에서 주로 발견되고 유기산 생성에 관여하는 미생물인 Clostridium sp., Lactobacillus sp., Seleomanas sp.에 의해 생산되는 부산물을 기반으로 네트워크가 구성되어 있으며, 유입된 기질 대비 생산물이 90% 이상일 때 신뢰도가 높다고 판단할 수 있다. 이 같은 기본 데이터를 바탕으로 Meta flux를 가동시킨 결과 투입된 글루코스 중 95% 이상이 계산되어 Flux 흐름을 만족하는 것으로 나타났다.
좀 더 자세한 결과를 살펴보면, 유입되는 글루코스 R1부터 내부 흐름 및 생산물과 관련된 R2∼R30으로 구성되었으며, 생산된 수소는 R13에 나타내었다. 수소와 유기산의 생산은 밀접한 관계를 가지고 있기 때문에 수소를 최대화하여 생산하기 위해서는 글루코스에서 피루브산(pyruvate)으로 전환되고 최종적으로는 수소 및 아세트산을 생산하는 R4, R12, R13의 반응이 이루어져야한다. 하지만 혼합미생물인 경우에는 글루코스로부터 피루브산까지 전환되고, 그 이후에는 미생물에 따라 유산, 뷰틸산, 에탄올, 프로판올, 프로피온산 등 다양한 물질들로 전환된다.
Fig. 4∼7은 계절변화에 따른 FBA 분석결과를 그림으로 나타내었다. 글루코스 1몰이 계 내로 유입되고 글루코스 1 mol/molHexose 중에서 이론적으로 수소가 생산된 것은 R12 경로에 의해 봄 1.684 mol/molHexose, 여름 1.279 mol/molHexose, 가을 1.764 mol/molHexose, 겨울 1.783 mol/molHexose이었으나, 실제 생산된 수소는 R13 경로에 의해 1.067, 0.711, 1.215, 1.131 mol/molHexose로 각각 0.617, 0.568, 0.549, 0.652 mol/molHexose 소모되었으며, 이는 대부분 수소와 이산화탄소를 이용하여 아세트산으로 전환하는 R17 반응에 의한 것임을 확인하였다. Butyrate는 생산된 유기산 중 약 50%를 차지하였고, FBA 분석 결과에서는 피루브산에서 아세틸-CoA로 전환되는 R10 반응과 2몰의 아세틸-CoA가 1몰의 Acetoacetyl-CoA(R23)를 거쳐 Butyryl-CoA로 되고 최종적으로 R24, R25의 반응으로 뷰틸산이 각각 0.510, 0.420, 0.483, 0.555 mol/molHexose가 생산되는 것을 확인하였으며, 이에 따라 정립된 관계식을 Table 4에 나타내었다.
3.4 미생물 군집변화
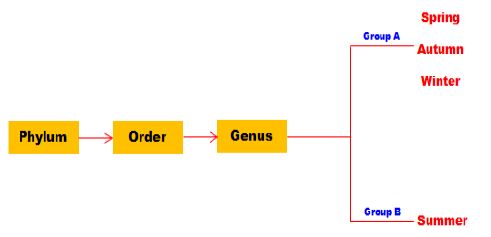
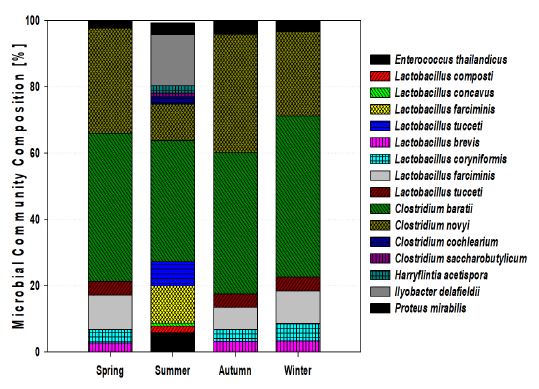
음폐수를 이용한 파이롯트 규모의 수소 발효 시, 계절변화에 따른 미생물 군집변화를 관찰하였으며, 그 결과를 Fig. 8에 나타내었다. Genus 수준에서 감지된 주요 종들을 species 수준으로 분석 하였다. 이들 각각의 우점도는 전체 미생물 분석결과를 100% 기준으로 할 때 전체 matching 정확도는 98% 이상이다. 미생물은 2개의 그룹으로 분류되었다. 봄, 가을, 겨울철은 그룹 A에 함께 군집되어 있었고, 여름철은 그룹 B로 군집되었다. 여름철 조건의 미생물 군집은 봄, 가울, 겨울철의 미생물 군집에도 포함되어 미생물 군집 구조가 조금 다르지만 그룹 A와 관련되어 있다는 것을 보여주는 것이라 판단된다.
발효 종료 시점에서 계절변화에 따른 미생물 분석결과를 Fig. 9와 Table 5에 나타내었으며, 젖산 생산 세균으로 알려진 Lactobacillus는 봄 21.3%, 여름 27.2%, 가을 17.5%, 겨울 22.6%로 나타났고, 젖산 생산균주들은 종 분석 결과, Lactobacillus brevis, Lactobacillus coryniformis, Lactobacillus farciminis, Lactobacillus tucceti로 나타났다. 또한 수소 생산균인 Clostridium은 76.2%, 50.8%, 78.3% 74%가 우점화 되는 것을 확인하였으며, 수소 생산에 관련된 미생물로는 Clostridium baratii, Clostridium novyi, Clostridium cochlearium, Clostridium saccharobutylicum로 나타났다. 특히 여름철의 경우 대표적인 젖산 생산균주 중 하나인 Enterococcus는 초기에 6%가 출현한 것을 확인하였다. 여름철의 미생물 군집변화에서 가장 특이점은 Ilyobacter delafieldii 라는 미생물이 15.3%로 나타났다. Ilyobacter는 아세트산과 프로피온산을 생산하는 박테리아로 유기산 변화와 관련하여 아세트산과 프로피온산이 증가하는 경향과 매우 밀접한 관련이 있을 것으로 판단된다. 또한 Proteus는 글루코오스로부터 산을 생산하는 미생물로 봄 2.5%, 여름 3.6% 가을 4.2%, 겨울 3.4%로 나타났다.
4. 결 론
본 연구에서는 음폐수를 이용한 혐기성 수소 발효과정에서 FBA(Flux Balance Analysis)프로그램을 이용하여 수소 및 유기산의 거동, 미생물군집변화를 확인하고 분석을 통하여 다음과 같은 결론을 얻었다.
- 1) 봄, 가을, 겨울의 경우 평균 전환율은 1.06∼1.21 mol H2/mol hexoseadded로 나타났다. 반면에 여름철의 경우 다른 계절 대비 약 50% 낮은 0.711 mol H2/mol hexoseadded의 전환율을 나타내었다. 이는 투입되는 음폐수의 낮은 탄수화물 농도에 기인한 것으로 사계절 각각의 탄수화물 함량은 봄 33.8%, 여름 25.3%, 가을 31.8%, 겨울 36.1%으로 확인되었다. 이론적 수소발생량은 1 mol의 포도당으로부터 12 mol의 수소가 생성된다. 이를 기준으로 수소 전환 효율은 봄 3.1%, 여름 1.49%, 가을 3.22%, 겨울 3.4%로 음폐수의 탄수화물 농도 대비 여름철이 가장 낮은 것으로 나타나 음식물류폐기물의 신속수거 체계 마련이 필요할 것으로 사료된다.
- 2) 유기산 변화를 살펴보면 수소생산과 직접적인 관련이 있는 butyrate의 비율이 4계절 평균 19.8 g COD/L로 총 발생 유기산 중 butyrate농도가 약 50%의 비율을 나타내었다. 그러나 여름철의 경우 수소생산량과 비례하게 13.5 g COD/L으로 가장 낮았으며, lactate 농도는 11.7 g COD/L로 33.1%를 차지하는 것으로 나타났다. 또한 수소발효 시 butyrate/acetate(B/A) 비율이 수소발생량과 비례한다고 보고되고 있으며, 본 실험에서는 2.25, 2.25, 2.04, 2.47 평균 2.25로 나타난 결과로 볼 때 음폐수를 이용한 수소발효의 성능이 안정적으로 이루어진 것으로 판단된다.
- 3) FBA(Flux Balance Analysis)프로그램을 이용한 수소 및 유기산의 거동 결과를 살펴보면 글루코스 1몰이 계 내로 유입되고 글루코스 1 mol/mol hexose 중에서 이론적으로 수소가 생산된 것은 봄 1.684 mol/mol hexose, 여름 1.279 mol/mol hexose, 가을 1.764 mol/mol hexose, 겨울 1.783mol/mol hexose이었으나, 실제 생산된 수소는 1.067, 0.711, 1.215, 1.131 mol/mol hexose로 각각 0.617, 0.568, 0.549, 0.652 mol/mol hexose소모되었으며, 이는 대부분 수소와 이산화탄소를 이용하여 아세트산으로 전환하는 반응에 의한 것임을 확인하였다. 또한 butyrate는 생산된 유기산 중 약 50%를 차지하였고, FBA 분석 결과에서는 피루브산에서 아세틸-CoA로 전환되는 R10 반응과 2몰의 아세틸-CoA가 1몰의 Acetoacetyl-CoA를 거쳐 Butyryl-CoA로 되고 최종적으로 각각의 반응으로 뷰틸산이 각각 0.510, 0.420, 0.483, 0.555 mol/mol hexose가 생산되는 것을 확인하였다.
- 4) 계절변화에 따른 미생물 군집변화를 관찰하였으며, 젖산 생산균으로 알려진 Lactobacillus는 봄 21.3%, 여름 27.2%, 가을 17.5%, 겨울 22.6%,로 나타났고, 수소 생산균인 Clostridium은 76.2%, 50.8%, 78.3% 74%가 우점화 되는 것을 확인하였으며, 수소 생산에 관련된 미생물로는 Clostridium baratii, Clostridium novyi, Clostridium cochlearium, Clostridium saccharobutylicum로 나타났다. 여름철의 미생물 군집변화에서 가장 특이점은 Ilyobacter delafieldii라는 미생물이 15.3%로 나타났다. Ilyobacter는 아세트산과 프로피온산을 생산하는 박테리아로 유기산 변화와 관련하여 아세트산과 프로피온산이 증가하는 경향과 매우 밀접한 관련이 있을 것으로 판단된다.
Acknowledgments
이 논문은 2021 학년도 한밭대학교 교내학술연구비의 지원을 받아 수행함.
References
- Metropolitan Area Landfill Management Corporation, 2016, “Guidelines for process operation and management of biogasification facilities for food wastewater”, https://www.slc.or.kr/upload/pdf/5.%EC%9D%8C%ED%8F%90%EC%88%98%20%EB%B0%94%EC%9D%B4%EC%98%A4%EA%B0%80%EC%8A%A4%ED%99%94%20%EC%8B%9C%EC%84%A4%20%EC%9A%B4%EC%98%81%EA%B4%80%EB%A6%AC%20%EA%B8%B0%EC%88%A0.pdf, .
- Ministry of Environment, 2019, “Study of food and logistics waste management policy direction and improvement plan”.
- Korea Environmental Industry & Technology Institute, 2016, “Technology trend for land treatment of wastewater”.
- Jang, Y.H., and Bae, J.G., 2009, “A study on the current status of domestic food wastewater treatment and treatment plan”, Proc. The Korean Society for Waste Recycling Spring Academic Research Society, 204-210.
-
Lee, J.P., and Kang, H., 2016, “Evaluation of the Performance Parameters with a Semi-Continuously Fed and Mixed Anaerobic Reactor using Food Waste”, New. Renew. Energy,12(4), 88-97.
[https://doi.org/10.7849/ksnre.2016.12.12.4.088]

-
Eshtiaghi, N., Markis, F., Yap, S.D., Baudez, J.C., and Slatter, P., 2013 “Rheological characterisation of municipal sludge: A review”, Water Res., 47(15), 5493-5510.
[https://doi.org/10.1016/j.watres.2013.07.001]

-
Karthikeyan, O.P., Trably, E., Mehariya, S., Bernet, N., Wong, J.W.C., and Carrere, H., 2018, “Pretreatment of food waste for methane and hydrogen recovery: A review”, Bioresour. Technol., 249, 1025-1039.
[https://doi.org/10.1016/j.biortech.2017.09.105]

- APHA (American Public Health Association), 2005, “Standard methods for the examination of water and astewater”, 21th Edition.
- Cho, K.M., 2019, “Optimization of hydrogen fermentation by acid pretreatmentof food waste”, Ph.D thesis, Department of Environmental Engineering, Han bat National University, Daejeon.
- Oh, S.D., 2006, “Effect of iron dust and HRT on the continuous biohydrogen production from food waste leachate using thermophilic ASBR”, Master’s thesis, KAIST, Daejeon.
-
Chen, C.C., Lin, C.Y., and Lin, M.C., 2002, “Acid-base enrichment enhances anaerobic hydrogen production process”, Applied Microbiology and Biotechnology, 58, 224-228.
[https://doi.org/10.1007/s002530100814]

- Khanal, S.K., Chen, W.H., Li, L., and Sung, S., 2001, “Biological hydrogen production: effects of pH and intermediate products”, Int. J. Hydrog. Energy, 29(11), 1123-1131.