Online publication date 19 Aug 2021
합성가스 발효에서 배지 내 Vitamin 농도의 에탄올 생산에 대한 영향
Copyright © 2021 by the New & Renewable Energy
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In this study, we assessed the effect of vitamin components (such as biotin, thiamine-HCl, and folic acid) on microorganism microbial growth and ethanol production was examined to enhance increase the ethanol concentration in the Clostridium autoethanogenum culture process using syngas as a sole carbon source. Biotin and folic acid concentrations of 0.2, 2, 20, and 100 μg/L were used in the culture experiments at 0.2, 2, 20, and 100 μg/L concentrations. The maximum ethanol concentrations of 2.81 g/L and 3.12 g/L were obtained by adding at 0.2 μg/L biotin and folic acid, respectively. Moreover, Thiaminethiamine-–HCl at concentrations of 0.5, 5, 50, and 250 μg/L were was examined evaluated to in the culture experiments. The maximum ethanol concentration of 2.84 g/L was observed at 0.5 μg/L of thiamine-–HCl. As a resultThus, the optimized concentrations of biotin, thiamine-–HCl, and folic acid were determined at 0.2, 0.5, and 0.2 μg/L, respectively, for enhancing increasing the ethanol production. In conclusion, the maximum ethanol production was obtained by adding the minimal concentration of vitamins in C. autoethanogenum culture.
Keywords:
Clostridium autoethanogenum, Syngas fermentation, Biotin, Thiamine-HCl, Folic acid, Medium optimization키워드:
클로트리디움 오토에타노게놈, 합성가스 발효, 비오틴, 티아민, 엽산, 배지 최적화1. 서 론
바이오연료는 수송용으로 활용성이 큰 환경친화적인 재생연료이며, 화석연료에 대한 의존성을 낮추고 온실가스 배출을 감축시킬 수 있는 차세대 에너지이다.[1,2] 바이오 연료 중 에탄올은 옥탄가가 휘발유와 비슷하여 휘발유와 혼합연료로 사용 가능하다고 알려져 있다.[3] 1세대 바이오 에탄올 생산 기술은 주로 옥수수, 사탕수수와 같은 곡물을 기반으로 한 발효 위주의 생산공정이며, 곡물을 재배하기 위한 많은 경작지가 필요하여 산림훼손의 문제를 야기하고 곡물가격이 급격하게 상승하는 문제를 유발하는 단점을 가지고 있다.[4,5] 2세대 바이오 에탄올 생산기술은 목재, 폐지와 같은 목질계 바이오매스를 원료로 하며, 주요 구성성분은 셀룰로오즈, 헤미셀룰로오즈, 리그닌이다.[6] 이러한 구성성분들을 이용하여 에탄올을 생산하기 위해서는 리그닌과 셀룰로오즈/헤미셀룰로오즈를 분리하고 유용화하는 전처리가 필수적이며, 이 과정에서 많은 비용을 소모되고 공정이 복잡해지는 문제를 가지고 있다.[7] 화학적 가수분해나 생물학적 효소 반응과 달리 가스화(gasification)는 리그닌을 비롯한 모든 바이오 매스의 구성 성분을 합성가스(syngas)로 간단하고 효과적으로 전환시킬 수 있다. 합성가스의 주성분인 일산화탄소(CO), 이산화탄소(CO2), 수소(H2)를 기질로 사용하는 미생물의 생물학적 발효를 통해 바이오 알코올을 직접 생산할 수 있는 기술이 최근 각광받고 있다.[8~10] Clostridium autoethanogenum과 같은 acetogen은 절대 혐기 조건에서 우드-융달회로(Wood-ljungdahl pathway)를 통해 acetyl-CoA과 같은 중간체를 생산하고, acetyl-CoA는 에탄올과 아세트산 등 유용산물로 전환될 수 있다.[11,12] 합성가스 성분 중 일산화탄소(CO), 이산화탄소(CO2) 는 탄소원으로 사용되고, 수소(H2)는 전자전달체로 사용된다.[13] 하지만 미생물을 이용한 합성가스의 생물학적 전환 시스템은 미생물의 성장속도가 현저히 느리고 최종 대사산물의 생산농도가 낮아 생산성이 떨어지는 한계를 가지고 있다.[14,15] 이 문제를 해결하기 위해 합성가스 조성, 배지 조성과 같은 배양운전 조건을 변화시키는 등 생물공학적 접근과 균주 개량 등을 통하여 생산성을 증가시키고자 하는 유전공학적 시도가 이루어져 왔다.[16~19] 대표적인 사례로 배지의 성분 중 탄소원, 질소원, 영양염류(질소 및 인), 중금속 등 다양한 배지구성 성분의 조성을 변화하는 시도가 이루어졌으며, 이러한 배지 성분의 변화는 acetogen 배양의 대사과정에 영향을 끼쳐 균주의 성장과 에탄올의 생산을 향상시킬 수 있다고 알려져 있다.[20~23] Acetogen 배지 성분 중 vitamin 성분들은 에탄올 생산을 위한 환원력(reducing power)을 제공하여, 미생물의 성장과 대사산물의 생산을 증가시킨다는 보고가 있으며, C. ragsdalei, C. autoethanogenum을 이용한 최근 연구에서 vitamin 성분 중 D-Ca-pantothenate, vitamin B12(cobalamin) 농도에 따른 미생물 성장과 대사산물의 생성 변화를 관찰하였다.[13,24]
본 연구에서는 합성가스 구성성분인 CO, CO2를 유일한 탄소원으로 사용하는 C. autoethanogenum 배양과정에서 배지 내 vitamin 성분의 농도를 변화시켜 균주 성장과 에탄올 생산에 미치는 영향을 조사하였다. 연구에 사용된 vitamin 성분은 biotin, thiamine-HCl과 folic acid이며, 각 성분의 농도를 달리하여 균주 성장과 에탄올, 아세트산 생산에 미치는 영향을 고찰하였다.
2. 실험재료 및 방법
2.1 균주 및 배양배지
실험에 사용된 미생물은 Clostridium autoethanogenum (DSM 10061)을 German Collection of Microorganisms and Cell Culture 에서 구입하였다. 균주 배양을 위한 기본 배지의 조성은 본 연구진의 기존 연구와 동일하며,[8] 배지는 시약용 화합물을 사용하여 제조하였다. Vitamin 성분은 vitamin용액을 별도로 제조한 후, 최종 배양 배지 1 L에 준비된 vitamin 용액 1 mL(x1,000배 희석)를 첨가하여 사용하였다. 본 연구에서 제시한 vitamin의 농도는 배양 배지 내 최종 농도로 표기하였다. 또한 실험에 사용된 합성가스는 MS 동민가스(Pyeongtaek, Gyeonggi-Do, Korea)에 제조 의뢰하여 공급되었으며 부피비 조성은 20% CO, 20% CO2, 10% H2, 50% N2으로 이루어져있다.
2.2 배지조성 변화 배양실험
배양 실험은 150 mL serum bottle을 배양기로 사용하여 25 mL의 배양 배지를 넣은 후, 고무마개와 알루미늄캡을 이용하여 외부 공기와 접촉을 차단시킨 상태에서 합성가스를 주입하여 절대 혐기 조건을 만들었다. C. autoethanogenum 균주는 절대 혐기성 균주이므로 완벽한 혐기조건의 유지는 매우 중요하다. 준비된 serum bottle에 계대배양에서 10일간 배양된 미생물 배양액을 접종액으로 사용하였으며, 배지 부피의 10 vol%를 접종하였다. 균주 접종 후, 탄소원 공급을 위해 serum bottle의 head space 부분에 합성가스를 5분 동안 주입하였으며, bottle내 내부압력은 약 240 kPa을 유지하도록 하였다. 준비된 serum bottle은 배양 온도 37℃와 교반속도 200 rpm 조건의 진탕배양기에서 배양하였다. 균주 성장과 대사산물 분석을 위한 시료는 48시간마다 고무마개 부분에 주사기를 통과시켜 배양액을 채취하였다.
균주 성장과 에탄올 생산에 대한 영향을 알아보기 위해 사용된 vitamin 성분의 농도는 각각 biotin 0.2, 2, 20, 100 μg/L, thiamine-HCl 0.5, 5, 50, 250 μg/L, folic acid 0.2, 2, 20, 100 μg/L 이다.
2.3 분석 방법
균주의 성장을 분석하기 위하여 UV-vis 분광광도계(Optizen POP, Mecasys Co., Korea)를 이용하여 파장 600 nm에서 배양액의 광밀도(optical density)를 측정하였다. 에탄올과 아세트산 농도 분석은 배양액을 원심분리하여 얻은 균주가 없는 상등액을 기공 크기가 0.45 μm인 syringe filter(6784-1304, Whatman, Germany)로 여과하여 분석시료를 준비하고, gas chromatograph (Agilent 7890B, Santa Clara, CA, USA)를 이용하여 측정하였다. 컬럼은 capillary coulumn(HP-5 column, 30 m × 0.32 mm × 0.25 μm), 검출기는 flame ionization detector (FID)를 이용하였고 이동상기체로 헬륨을 사용하였다.
3. 결과 및 고찰
3.1 Biotin의 농도가 미생물 성장과 에탄올 생산에 미치는 영향
균주가 성장하는데 필수적인 vitamin 중 하나인 biotin이 C. autoethanogenum의 성장과 에탄올, 아세트산 생산에 미치는 영향을 분석한 결과를 Fig. 1에 표시하였다.
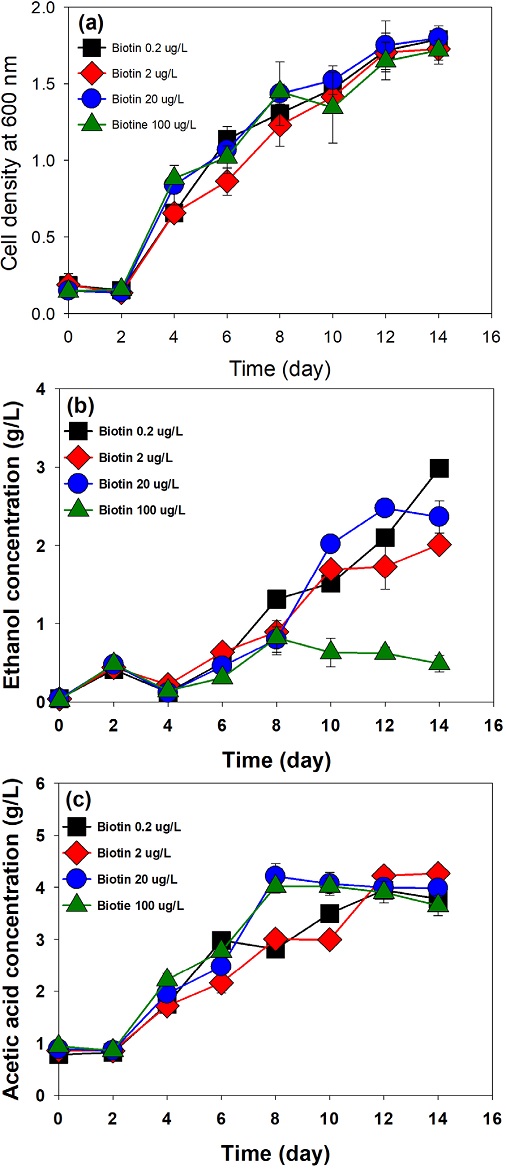
Growth and metabolite production characteristics in Clostridium autoethanogenum at various biotin concentration: cell density at 600 nm, ethanol concentration, and acetic acid concentration. Error bars (n=3) represented ±1 standard deviation
기본 배양 배지에서 biotin의 농도는 20 μg/L이며, 농도를 0.2, 2, 20, 100 μg/L로 변화시킨 실험에서, 균주의 최대 OD인 1.80은 biotin 20 μg/L 농도에서 관찰되었으나 미생물의 성장 차이는 시험농도범위 내에서 큰 영향을 보이지 않았다(Fig. 1(a)). Botryococcus braunii Kützing를 대상으로 한 연구에서 수용성 비타민 중의 하나인 biotin은 미생물 성장에 필수적이긴 하지만 최소한의 농도로만으로도 성장이 가능하다고 밝힌 바 있으며, 이는 biotin의 농도가 C. autoethanogenum의 성장에 근본적인 영향을 주지 않는 본 연구의 실험 결과와 부합한다.[25] Biotin의 농도가 에탄올 및 아세트산 생산에 미치는 영향을 알아보기 위해 14일 배양 기간 중 에탄올과 아세트산 생산농도 변화를 분석하였다(Fig. 1(b), 1(c)). 분석 결과, biotin 0.2 μg/L의 조건에서 에탄올의 생산농도가 2.81 g/L로 가장 높았으며, 기본 배지 조건(20 μg/L)의 생산농도와 비교했을 때 27% 증가된 수치는 보이지만 생산 경향의 변화가 크지 않으며, 아세트산 생산에 대한 영향도 크지 않다. 다만, 100 μg/L를 사용한 경우 에탄올 생산은 거의 이루어지지 못하는 것으로 보인다.
Clostridium 속 균주와 P. tannophilus 를 이용한 타 연구에서 biotin은 acetyl-CoA 생합성에 필요한 보조 인자이며, 농도가 증가되면 Wood-ljungdahl pathway에서 acetyl-CoA는 pyruvte로 가는 경로가 활성화되어 2,3-butanediol생성이 증가되지만, 농도를 낮게 제한하면 acetyl-CoA의 생성속도가 CO cycle 속도보다 감소하여 NAD(P)H가 증가하고 에탄올 생산이 증가되는 결과를 보였고, biotin을 첨가하지 않는 경우에는 에탄올의 생산이 저해되는 경향을 보였다.[24,26,27]
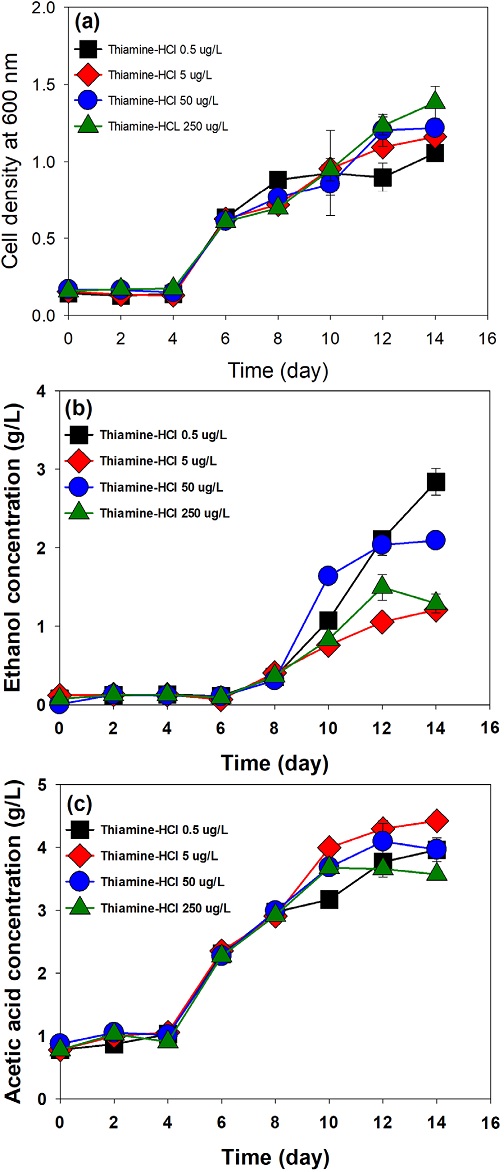
3.2 Thiamine-HCl의 농도가 미생물 성장과 에탄올 생산에 미치는 영향
균주가 성장하는 데 필수적인 비타민 구성 성분 중 thiamine-HCl 이 C. autoethanogenum 의 성장과 에탄올, 아세트산 생산에 미치는 영향을 분석한 결과를 Fig. 2에 도시하였다. 기본 배양 배지에서 thiamine-HCl 농도는 50 μg/L이며, 농도를 0.5, 5, 50, 250 μg/L로 변화시켜 배양 실험을 수행한 결과, thiamine-HCl 250 μg/L 조건에서 최대 OD인 1.38을 얻었으며, thiamine-HCl의 농도를 증가시킬수록 미생물의 성장이 향상되는 경향을 보이지만, 그 차이는 크지 않았다(Fig. 2(a)). 이 결과는 Chlorococcum minutum을 이용한 연구에서 thiamine-HCl은 아미노산 생합성과 탄수화물 대사에 관여하는 보조 인자로, thiamine-HCl의 사용량 증가는 세포 내의 충분한 에너지를 공급해 균주의 성장을 증가시킬 수 있다는 결과와 유사한다.[28] 또한 thiamine-HCl의 농도가 에탄올 및 아세트산 생산에 미치는 영향을 알아보기 위해 14일 배양 기간 중 에탄올과 아세트산의 생산 농도 변화를 분석하였다(Fig. 2(b), 2(c)). Thiamine-HCl 0.5 μg/L 조건에서 최대 에탄올 생산농도인 2.84 g/L이 관찰되었으며, 기본 배양 배지 조건(50 μg/L)의 생산농도와 비교해볼 때 36% 증가하였다. Helminthosporium maydis을 이용한 연구에서 thiamine-HCl은 pyruvate의 전구체로, 과량의 thiamine은 PDH(pyruvate dehydrogenase)의 활성을 증가시켜 2,3-butanediol의 생산을 증가시키지만, 배지 내 저농도의 thiamine의 첨가한 경우, NADH의 양을 증가시켜 ADH(Alcohol dehydrogenase)의 활성을 향상시켜 에탄올 생산을 증가시키며, 배지 내 thiamine-HCl 이 첨가 되지 않을 경우에도 다른 비타민 성분이 있다면 ADH는 다른 비타민의 영향을 받아 에탄올 생산이 증가될 수 있다는 선행 연구가 있다.[26,29]
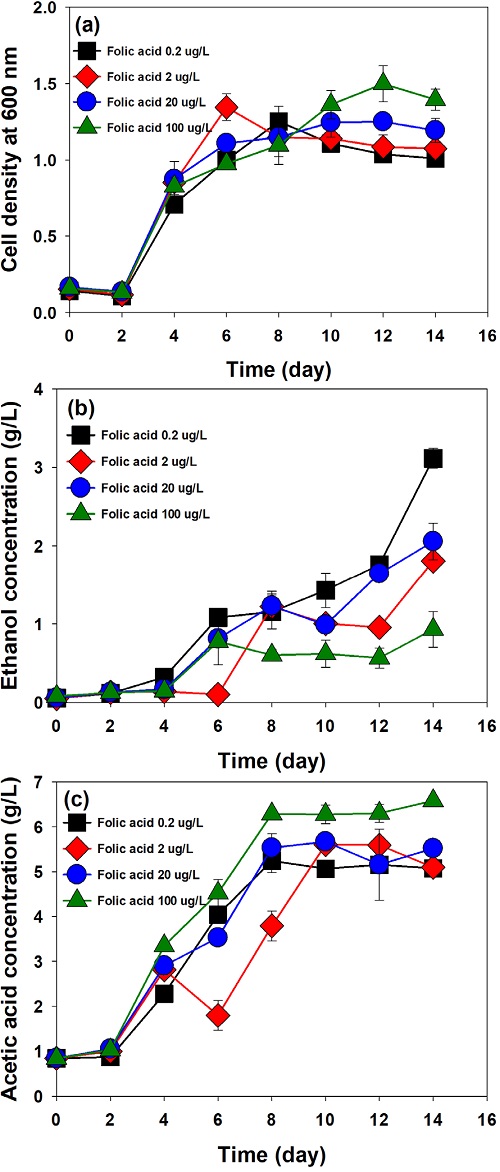
3.3 Folic acid의 농도가 미생물 성장과 에탄올 생산에 미치는 영향
Figure 3은 미생물이 성장하는 데 필수적인 비타민 구성 성분 중 folic acid가 C. autoethanogenum의 성장과 에탄올, 아세트산 생산에 미치는 영향을 분석한 결과이다. 기본 배양 배지에서 folic acid 농도는 20 μg/L 이며, 농도를 0.2, 2, 20, 100 μg/L로 변화시키며 배양 실험을 수행한 결과, folic acid를 100 μg/L 사용한 조건에서 최대 OD인 1.40을 보여(Fig. 3(a)), folic aicd의 농도를 증가시킬수록 균주 성장이 향상되지만, 차이가 매우 크지는 않다. E. coli를 이용한 연구에서 folic acid의 농도가 증가할수록 균주의 성장이 증가된 결과와 유사한 경향을 보였다.[30] Folic acid는 아미노산의 생합성에 관여하는 보조 인자로 작용하며 과량으로 공급할수록 미생물의 성장이 증가된 것으로 보인다. 또한 folic acid의 농도가 에탄올 및 아세트산에 미치는 영향을 알아보기 위해 배양 14일간 에탄올과 아세트산 농도를 분석하였다(Fig. 3(b), 3(c)). Folic acid 0.2 μg/L 조건에서 에탄올의 생산농도가 3.12 g/L로 가장 높았으며, 기본 배지 조건(20 μg/L)에서 생산된 에탄올 농도(2.06 g/L)보다 51% 증가된 수치이다. Clostridium acetobutylicum을 이용한 연구에서 미생물이 대사적으로 folic acid를 tetrahydrofolate로 전환할 수 있어, folic acid의 농도를 제한할수록 Wood-ljungdahl pathway에서 tetrahydrofolate 생성 속도를 감소시켜 에탄올 생산에 관여하는 효소 활성에 영향을 끼치고 NADH와 같은 환원력을 증가시켜 에탄올 생산이 향상되며, 배지 내 folic acid를 첨가하지 않는 경우에 tetrahydrofolate 생성이 억제되어 에탄올의 생산이 저해될 수 있다는 결과가 보고되어 있다.[31]
4. 결 론
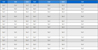
본 연구에서는 배지의 구성성분 중 비타민 성분인 biotin, thiamine-HCl, folic acid의 농도 변화가 혐기성 박테리아인 C. autoethanogenum의 성장과 에탄올, 아세트산 생산농도에 끼치는 영향을 분석하였으며, 그 결과를 Table 1에 간략하게 요약하였다. 실험 결과, biotin의 농도에 따른 균주의 성장 변화는 크게 관찰되지 않았으며, thiamine-HCl과 folic acid는 기본 배지 농도에 비해 과잉 공급한 경우 균주의 성장이 소폭 증가되는 경향을 보였다. 하지만, 균주 성장의 증가 정도는 크다고 볼 수 없다. 또한 biotin의 경우, 0.2 μg/L에서 최대 에탄올 생산농도인 2.81 g/L를 얻었으며, 이는 20 μg/L를 사용하는 기본 배지 조건과 비교하였을 때 27% 향상된 결과이다. Thiamine-HCl의 경우, 0.5 μg/L에서 최대 에탄올 생산농도인 2.84 g/L가 관찰되었고, 50 μg/L를 사용하는 기본 배지 조건과 비교했을 때 36% 향상된 결과이다. Folic acid는 0.2 μg/L에서 최대 에탄올 생산농도인 3.12 g/L가 얻어졌고, 20 μg/L를 사용하는 기본 배지 조건과 에탄올 생산농도를 비교했을 때 51% 향상되었다. 실험에 사용된 모든 비타민 성분들은 기본 배지 조건의 0.01배인 최소사용량에서 에탄올 생산농도가 최대값을 보였다. 결론적으로 배지 내 thiamine-HCl, folic acid 는 많이 공급하면 균주의 성장에는 도움을 주지만 그 효과는 크지 않았다. 하지만, 기본배지 농도의 5배의 비타민을 공급한 경우는 에탄올 생산이 크게 저해 받는 것을 관찰하였고, 비타민 농도를 제한할수록 에탄올 생산농도는 증가하는 것을 확인하였다. 따라서, 에탄올 생산성이 높은 합성가스 발효공정을 위해서는 낮은 농도의 vitamin을 안정적으로 유지하는 운전전략이 유용하다고 판단된다.
Acknowledgments
이 연구는 교육부의 재원으로 한국연구재단-이공학개인기초연구지원사업(NRF-2018R1D1A1B07043323)의 지원을 받아 수행한 연구입니다.
References
-
Kul, B.S., and Ciniviz M., 2021, “An evaluation based on energy and exergy analyses in SI engine fueled with waste bread bioethanol-gasoline blends”, Fuel, 286(2), 119375.
[https://doi.org/10.1016/j.fuel.2020.119375]

-
Seo, H., Kim, H., and Jeon, E., 2019, “Environmental improvement effect and social benefit: Focusing on bio-heavy oil power generation”, New. Renew. Energy, 15(3), 85-92.
[https://doi.org/10.7849/ksnre.2019.9.15.3.085]

-
Esmaeili, S.A.H., Sobhani, A., Szmerekovsky, J., Dybing, A., and Pourhashem, G., 2020, “First generation vs. second generation: A market incentives analysis for bioethanol supply chains with carbon policies”, Appl. Energy, 277(1), 115606.
[https://doi.org/10.1016/j.apenergy.2020.115606]

-
Nunes, L.J.R., Causer, T.P., and Ciolkosz, D., 2020, “Biomass for energy: A review on supply chain management models”, Renew. Sust. Energ. Rev., 120, 109658.
[https://doi.org/10.1016/j.rser.2019.109658]

-
Joshi, G., Pandey, J.K., Rana S., and Rawat, D.S., 2017, “Challenges and opportunities for the application of biofuel”, Renew. Sust. Energ. Rev., 79, 850-866.
[https://doi.org/10.1016/j.rser.2017.05.185]

-
Sharma, B., Larroche, C., and Dussap, D.-G., 2020 “Comprehensive assessment of 2G bioethanol production”, Bioresour. Technol., 313, 123630.
[https://doi.org/10.1016/j.biortech.2020.123630]

-
Zaafouri, K., Ziadi, M., Farah, R.B., Farid, M., Hamdi, and M., Regaya, I., 2016, “Potential of Tunisian Alfa (Stipa tenacissima) fibers for energy recovery to 2G bioethanol: Study of pretreatment, enzymatic saccharification and fermentation”, Biomass Bioenergy, 94, 66-77.
[https://doi.org/10.1016/j.biombioe.2016.08.008]

- Im, H.R., Kwon, R.K., Park, S.E., and Kim, Y.-K., 2020, “Effect of heavy metal on syngas fermentation using Clostridium autoethanogenum”, Appl. Chem. Eng., 31(4), 423-428.
-
Liu, C., Luo, G., Wang, W., He, Y., Zhang, R., and Liu, G., 2018, “The effects of pH and temperature on the acetate production and microbial community compositions by syngas fermentation”, Fuel, 224, 537-544.
[https://doi.org/10.1016/j.fuel.2018.03.125]

-
Pardo-Planas, O., Atiyeh, H.K., Phillips, J.R., Aichele, C.P., and Moharmmad, S., 2017, “Process simulation of ethanol production from biomass gasification and syngas fermentation”, Bioresour. Technol., 245, 925-932.
[https://doi.org/10.1016/j.biortech.2017.08.193]

-
Piatek, P., Olsson, L., and Nygård, Y., 2020, “Adaptation during propagation improves Clostridium autoethanogenum tolerance towards benzene, toluene and xylenes during gas fermentation”, Bioresour. Technol. Rep., 12, 100564.
[https://doi.org/10.1016/j.biteb.2020.100564]

-
Slivka, R.M., Chinn, M.S., Grunden, A.M., and Bruno-Bárcena J.M., 2020, “An iterative approach to improve xylose consumption by Clostridium autoethanogenum: From substrate concentration to pH adjustment”, Biomass Bioenergy, 140, 105663.
[https://doi.org/10.1016/j.biombioe.2020.105663]

- Im, H.R., An, T.G., Park, S.E., and Kim, Y.-K., 2019, “Effect of vitamin and Sulfur sources on syngas fermentation using Clostridium autoethanogenum”, Appl. Chem. Eng., 30(6), 681-686.
-
Anggraini, I.D., Kresnowati, P., Purwadi, R., and Setiadi, T., 2018, “Bioethanol production via syngas fermentation”, MATEC Web Conf., 156, 03025.
[https://doi.org/10.1051/matecconf/201815603025]

-
Jack, J., Lo, J., Maness, P.-C., and Ren, Z.J., 2019, “Directing Clostridium ljungdahlii fermentation products via hydrogen to carbon monoxide ratio in syngas”, Biomass Bioenergy, 124, 95-101, OI:10.1016/j.biombioe. 2019.03.011.
[https://doi.org/10.1016/j.biombioe.2019.03.011]

-
Sim, J.H., Kamaruddin, A.H., and Long, W.S., 2008, “Biocatalytic conversion of CO to acetic acid by Clostridium aceticum – Medium optimization using response surface methodology (RSM)”, Biochem. Eng. J., 40(2), 337-347.
[https://doi.org/10.1016/j.bej.2008.01.006]

-
Urgerman, A.J., and Heindel, T.J., 2007, “Carbon monoxide mass transfer for syngas fermentation in a stirred tank reactor with dual impeller configurations”, Biotechnol. Progr., 23, 613-620.
[https://doi.org/10.1021/bp060311z]

-
Saxena, J., and Tanner, R.S., 2011, “Effect of trace metals on ethanol production from synthesis gas by the ethanologenic acetogen Clostridium ragsdalei” J. Ind. Microbiol. Biot., 38(4), 513-521.
[https://doi.org/10.1007/s10295-010-0794-6]

-
Devi, M.P., Mohan, S.V., Mohanakrishna, G., and Sarma, P.N., 2010, “Regulatory influence of CO2 supplementation on fermentative hydrogen production process”, Ind. J. Hydrogen Energy, 35(19), 10701-10709.
[https://doi.org/10.1016/j.ijhydene.2010.03.024]

-
Nalakath, H., Veiga, M.C., and Kennes, C., 2011, “Biological conversion of carbon monoxide: Rich syngas or waste gases to bioethanol”, Biofuel. Bioprod. Biorefin., 5(1), 93-114.
[https://doi.org/10.1002/bbb.256]

- Adams, S. S., Scott, S., and Ko, C.-W., 2015, “Method for sustaining microorganism culture in syngas fermentation process in decreased concentration or absence of various substrates”, US Patent No. 9034618, May 19, 2015.
-
Phillips, J.R., Atiyeh, H.K., Tanner, R.S., Torres, J.R., Saxena, J., Wilkins, M.R., and Huhnke, R.L., 2015, “Butanol and hexanol production in Clostridium carboxidivorans syngas fermentation: Medium development and culture techniques”, Bioresour. Techcnol. 190, 114-121.
[https://doi.org/10.1016/j.biortech.2015.04.043]

-
Sun, X., Atiyeh, H.K., Tanner, R.S., and Huhnke, R.L., 2019, “Enhanced ethanol production from syngas by Clostridium ragsdalei in continuous stirred tank reactor using medium with poultry litter biochar”, Appl. Energy. 236, 1269-1279.
[https://doi.org/10.1016/j.apenergy.2018.12.010]

-
Kundiyana, D.K., Huhnke, R.L., and Wilkins, M.R., 2011, “Effect of nutrient limitation and two-stage continuous fermentor design on productivities during “Clostridium ragsdalei”, syngas fermentation”, Bioresour. Technol. 102(10), 6058-6064.
[https://doi.org/10.1016/j.biortech.2011.03.020]

-
Ruangsomboon, S., Sornchai, P., and Prachom, N., 2018, “Enhanced hydrocarbon production and improved biodiesel qualities of Botryococcus braunii KMITL 5 by vitamins thiamine, biotin and cobalamin supplementation”, Algal Res. 29, 159-169.
[https://doi.org/10.1016/j.algal.2017.11.028]

- Smart, K.F., and Boi, S.L., 2015, “Fermentation process for the production and control of pyruvate-derived products”, US patent No. 9701987, July 11, 2017.
-
Lee, H., Atkin, A. L., Barbosa, M. F. S., Dorscheid, D. R., and Schneider, H., 1988, “Effect of biotin limitation on the conversion of xylose to ethanol and xylitol by Pachysolen tannophilus and Candida guilliermondii”, Enzyme Microb. 10(2), 81-84.
[https://doi.org/10.1016/0141-0229(88)90002-6]

-
Varaprasad, D., Narasimham, D., Paramesh, K., Sudha, N.R., Himabindu, Y., Kumari, M.K., Parveen, S.N., and Chandrasekhar, T., 2019, “Improvement of ethanol production using green alga Cholorococcum minutum”, Environ. Technol. 42(9), 1383-1391.
[https://doi.org/10.1080/09593330.2019.1669719]

-
Evans, R.C., and Garraway, M.O., 1976, “Effect of thiamine on ethanol and pyruvate production in Helminthosporium maydis”, Plant Physiol. 57(5), 812.
[https://doi.org/10.1104/pp.57.5.812]

-
Maynard, C., Cummins, L., Green, J., and Weinkove, D., 2018, “A bacterial route for folic acid supplementation” BMC Biol., 16(1), 67.
[https://doi.org/10.1186/s12915-018-0534-3]

-
Nlimbalkar, R.R., Khedkar, M.A., Chavan, P.V., and Bankar, S.B., 2019, “Enhanced biobutanol production in folic acid-induced medium by using Clostridium acetobutylicum NRRL B-527”, ACS Omega, 4(7), 12978-12982.
[https://doi.org/10.1021/acsomega.9b00583]